Содержание
- 2. HCl= H + + Cl- HNO3 = H+ + NO3- H2SO4=2H+ + SO42- Общие свойства кислот
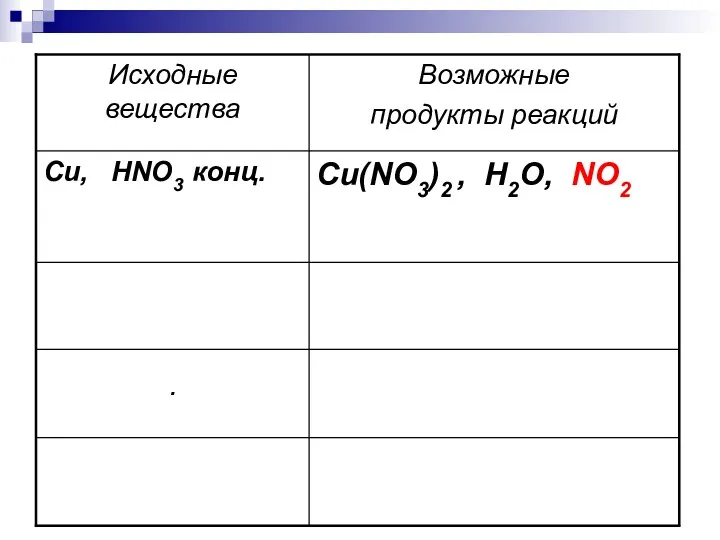
- 5. Cu + 4HNO3 = Cu (NO3)2+2H2O + 2NO2 конц.
- 6. Тема: Взаимодействие азотной кислоты с металлами Цели: Выяснить причину необычного поведения азотной кислоты при взаимодействии с
- 7. Zn, HNO3 разб. Zn(NO3)2, H2O, N2O Cu, HNO3 разб. Cu(NO3)2 , H2O, NO Ag, HNO3 конц.
- 8. Металл + HNO3 →соль + вода + соединение азота ЗАПОМНИТЕ! При взаимодействии азотной кислоты с металлами
- 9. окисление вос-ль ок-ль восстановление
- 10. 1 окисление вос-ль ок-ль 2 восстановление
- 12. Скачать презентацию








 Rates of reaction
Rates of reaction Пластмассалар, пластикалық материалдар
Пластмассалар, пластикалық материалдар Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки
Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки Азот. Аммиак (9 класс)
Азот. Аммиак (9 класс) Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню
Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii
osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii Ароматические соединения
Ароматические соединения Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Относительная атомная и молекулярная массы
Относительная атомная и молекулярная массы Кислоты. Состав, названия и определение кислот
Кислоты. Состав, названия и определение кислот Introduction to Periodic Table
Introduction to Periodic Table Алкилсульфонаттарды алу және технологиялық сызбанұсқасы
Алкилсульфонаттарды алу және технологиялық сызбанұсқасы Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Етери та естери
Етери та естери Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Аминокислоты N H2 – C H – C O O H
Аминокислоты N H2 – C H – C O O H Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Азотная кислота
Азотная кислота Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Подземное хранение газа и жидкости
Подземное хранение газа и жидкости Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Метал конструкциялық материалдар
Метал конструкциялық материалдар Вуглеводи
Вуглеводи Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ