Содержание
- 2. ВСПОМНИМ Чему равно общее количество электронов в атоме? Что такое энергетический уровень? Как определить число энергетических
- 3. ЗАПОМНИМ Электроны, расположенные на последней электронной оболочке, называются внешними. Число внешних электронов для химических элементов главных
- 4. Проверим домашнее задание
- 5. Проверьте себя и поставьте оценку, равную количеству правильных ответов Задание 1 Вариант I - а) Al
- 6. ТЕМА УРОКА «Строение электронных оболочек атомов химических элементов №1-20»
- 7. Цель урока: научиться составлять электронные формулы атомов элементов первых трех периодов ПСХЭ; объяснять зависимость и закономерные
- 8. Электронная оболочка Совокупность всех электронов в атоме, окружающих ядро Каждый электрон имеет свою траекторию движения и
- 9. S – облако p- облака d - облака Область наиболее вероятного местонахождения электрона в пространстве Форма
- 10. Алгоритм составления электронных формул. Записываем знак химического элемента и заряд ядра его атома – он равен
- 11. 1 период Н + 1 1 n=1 S 1 S1 Нe + 2 2 n=1 S
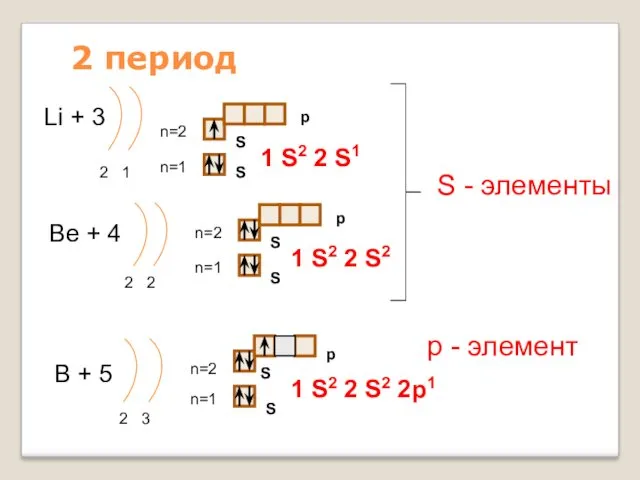
- 12. 2 период Li + 3 2 1 n=1 n=2 1 S2 2 S1 Be + 4
- 13. 2 период С + 6 2 4 n=1 n=2 N + 7 2 5 n=1 n=2
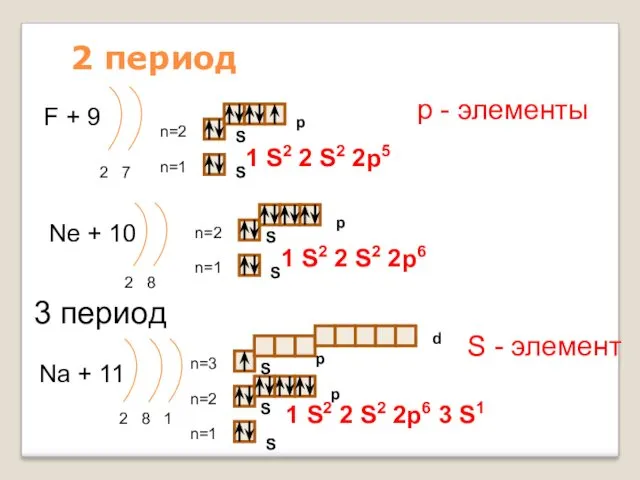
- 14. 2 период F + 9 2 7 n=1 n=2 Ne + 10 2 8 n=1 n=2
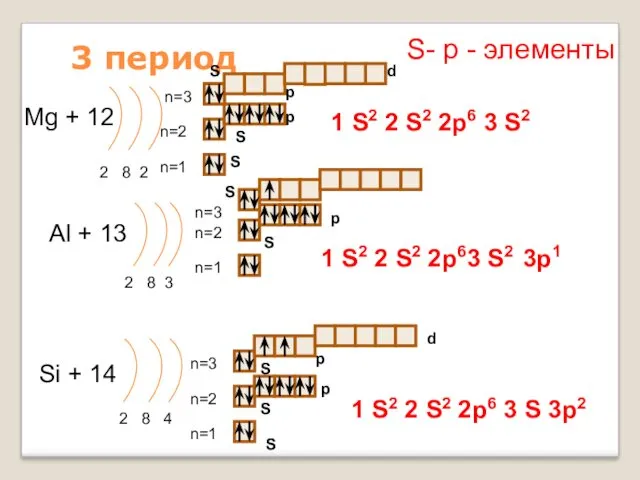
- 15. 3 период Mg + 12 2 8 2 n=1 n=2 Al + 13 2 8 3
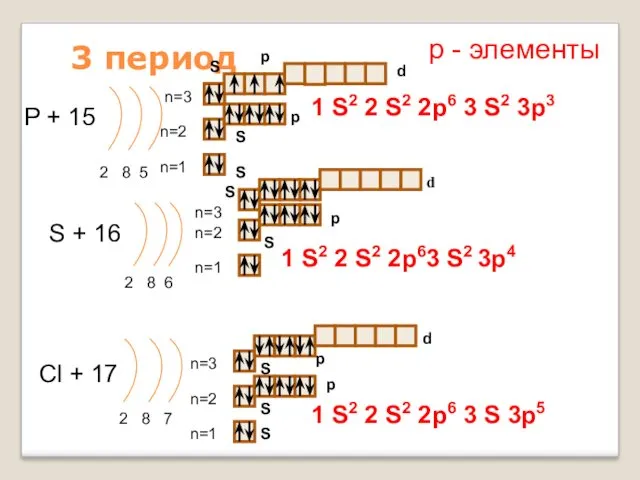
- 16. 3 период P + 15 2 8 5 n=1 n=2 S + 16 2 8 6
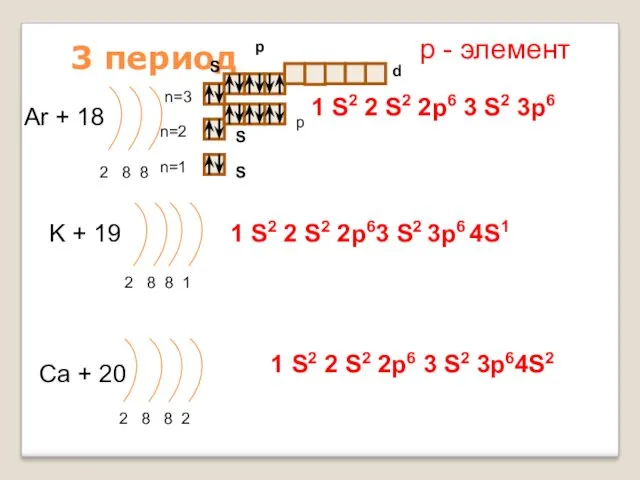
- 17. 3 период Ar + 18 2 8 8 n=1 n=2 K + 19 2 8 8
- 18. Физкультминутка Следим глазами
- 19. Закрепление материала Определить число орбиталей http://files.school-collection.edu.ru/dlrstore/bb14a031-aae7-11db-abbd-0800200c9a66/ch08_08_04.swf Определить число электронов на внешнем электронном уровне http://files.school-collection.edu.ru/dlrstore/bb14a032-aae7-11db-abbd-0800200c9a66/ch08_08_05.swf Определить общее
- 20. Ответьте на вопросы Какие данные об особенностях строения атома отражает электронная формула? В чем заключается причина
- 21. Выводы Причина сходства элементов заключается в одинаковом строении внешних энергетических уровней их атомов Одинаковое строение внешних
- 22. Домашнее задание Повторить основные понятия темы на странице с.46-53 учебника Задание №2, 3 письменно
- 24. Скачать презентацию
















 Rates of reaction
Rates of reaction Пластмассалар, пластикалық материалдар
Пластмассалар, пластикалық материалдар Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки
Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки Азот. Аммиак (9 класс)
Азот. Аммиак (9 класс) Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню
Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii
osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii Ароматические соединения
Ароматические соединения Относительная атомная и молекулярная массы
Относительная атомная и молекулярная массы Кислоты. Состав, названия и определение кислот
Кислоты. Состав, названия и определение кислот Introduction to Periodic Table
Introduction to Periodic Table Алкилсульфонаттарды алу және технологиялық сызбанұсқасы
Алкилсульфонаттарды алу және технологиялық сызбанұсқасы Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Етери та естери
Етери та естери Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Аминокислоты N H2 – C H – C O O H
Аминокислоты N H2 – C H – C O O H Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Азотная кислота
Азотная кислота Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Подземное хранение газа и жидкости
Подземное хранение газа и жидкости Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Метал конструкциялық материалдар
Метал конструкциялық материалдар Вуглеводи
Вуглеводи Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ