Слайд 2

тема урока
Относительная атомная и молекулярная массы
Слайд 3
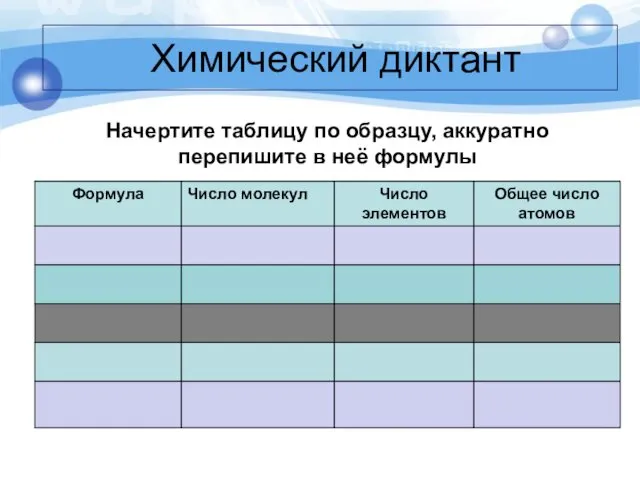
Химический диктант
Начертите таблицу по образцу, аккуратно перепишите в неё формулы
Слайд 4
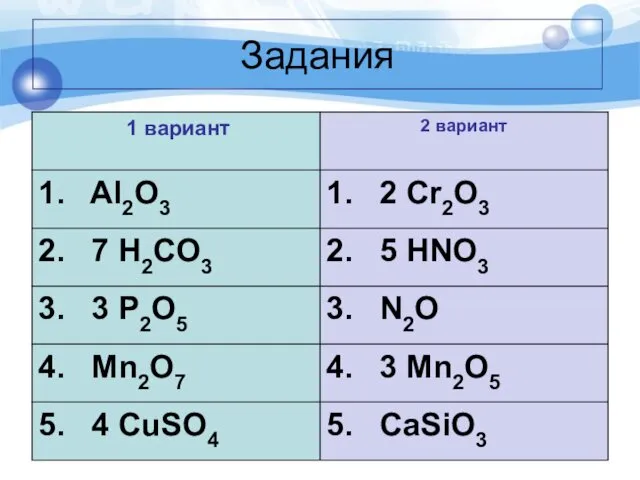
Слайд 5

Относительная атомная масса
Атомы элементов характеризуются определённой (только им присущей) массой.
Например,
масса
атома Н равна 1,67 · 10−23 г, атома С − 1,995 · 10−23 г, атома О − 2,66 · 10−23 г.
Слайд 6

Относительная атомная масса
Пользоваться такими малыми значениями неудобно, поэтому введено понятие
об относительной атомной массе Аr - отношении массы атома данного элемента к атомной единице массы (1,6605 · 10−24 г).
Слайд 7

Относительная молекулярная масса - Мr
Значения относительной молекулярной массы рассчитываются из
значений относительной атомной массы с учётом числа атомов каждого элемента в формульной единице сложного вещества. Атомы и молекулы - частицы чрезвычайно малые, поэтому порции веществ, которые берутся для химических реакций, характеризуются физическими величинами, соответствующими большому числу частиц.
Мr = bAr (элемента 1)+ mAr(элемента 2)
Слайд 8

Относительная молекулярная масса - Мr
Установлено, что
12 г углерода (в
виде графита или алмаза) содержат 6,02 · 1023 атомов С (Аr = 12),
28 г азота N2 содержат то же число молекул N2 (Mr = 28),
18 г H2O - то же число молекул H2O (Mr = 18) и т.д.
Слайд 9

Массовая доля элемента в сложном веществе
По известной химической формуле сложного вещества
определяют массовые доли элементов, входящих в это вещество. Массовая доля элемента (wЭ) в общей массе сложного вещества - это отношение массы, приходящейся на этот элемент (то есть массы части), к массе всего вещества (то есть к массе целого):
wЭ = mЭ/mвещ
Слайд 10

Массовая доля элемента в сложном веществе
Массовая доля элемента - это доля
от единицы или доля от 100%. В сложном веществе wЭ всегда меньше единицы (или меньше 100%).
Например, для воды H2O
wH = 0,11 (11%) и wO = 0,89 (89%).
Сумма массовых долей элементов, входящих в сложное вещество, равна 1 (100%).
Слайд 11

Домашнее задание
§ 5,
№ 6,7,8










 Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Хлороводород и соляная кислота
Хлороводород и соляная кислота Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Кальций и его соединения
Кальций и его соединения Получение Н2, О2, щелочей
Получение Н2, О2, щелочей Химическое сопротивление меди и ее сплавов
Химическое сопротивление меди и ее сплавов Природні ароматичні сполуки
Природні ароматичні сполуки Влияние этилового спирта на организм детей
Влияние этилового спирта на организм детей Таблица Менделеева
Таблица Менделеева Смоги и их влияние на человека
Смоги и их влияние на человека Вода как среда и участник протекания биохимических процессов в организме
Вода как среда и участник протекания биохимических процессов в организме Особенности строения, реакционной способности и методы синтеза карбоновых кислот и функциональных производных
Особенности строения, реакционной способности и методы синтеза карбоновых кислот и функциональных производных Химия окружающей среды
Химия окружающей среды Классификация и свойства оксидов
Классификация и свойства оксидов Основные понятия и законы химии
Основные понятия и законы химии Предельные углеводороды. Алканы. 10 класс
Предельные углеводороды. Алканы. 10 класс Аминокислоты. Белки
Аминокислоты. Белки Своя игра по химии
Своя игра по химии Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Основные классы неорганических соединений
Основные классы неорганических соединений Каменный уголь
Каменный уголь Активизация познавательной деятельности учащихся на уроках химии
Активизация познавательной деятельности учащихся на уроках химии Игрушка слайм-лизун. Создание собственной игрушки-лизуна в домашних условиях
Игрушка слайм-лизун. Создание собственной игрушки-лизуна в домашних условиях Углеводороды: предельные и непредельные
Углеводороды: предельные и непредельные Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда