Содержание
- 2. Из истории открытия Строение атома Нахождение в природе Физические свойства Химические свойства Получение Оксид кальция Гидроксид
- 3. Из истории открытия 1808г англ. химик Хэмфри Дэви выделил металлический кальций электролитическим методом. Calcis – «известь»,
- 4. Строение атома Са +20 ) ) ) ) 2е 8е 8е 2е Степени окисления: 0, +2
- 5. Нахождение в природе 3,6% в земной коре CaCO3 - карбонат кальция( мел, мрамор, известняк) СаSO4● Н2О
- 6. Сталактиты Сталагмиты
- 7. Физические свойства Цвет : серебристо – белый Твёрдый Лёгкий (плотность 1,55 г / см3) Температура плавления
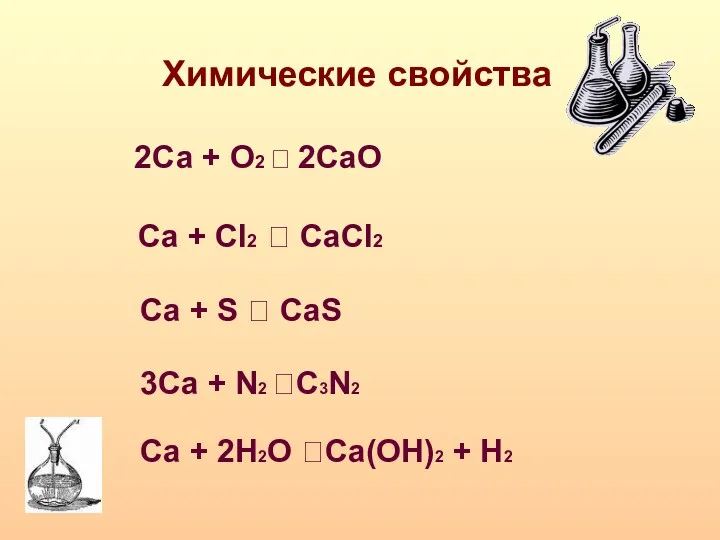
- 8. Химические свойства 2Са + О2 ? 2CаО Са + Сl2 ? CaCl2 Ca + S ?
- 9. Получение электролиз расплава СаСl2?Ca + Cl2 алюминотермия 3СаО + 2Аl ?3Ca + Al2O3
- 10. В промышленности кальций получают двумя способами: 1.Электролизом расплава CaCl2 и KCl с жидким медно-кальциевым катодом приготовляют
- 11. Биологическая роль
- 12. Соединения кальция
- 13. Оксид кальция СаО негашёная известь жжёная известь кипелка СаО + Н2О?Са(ОН)2 СаО + 2НСl ?CaCl2+H2O
- 14. Гидроксид кальция Са(ОН)2 гашеная известь пушонка Са(ОН)2 + СО2?CaCO3 + H2O известковое молоко
- 15. Применение кальция и его соединений
- 16. Са-восстановитель U,Th,Cr,V,Zr,Cs,Rb и некоторых других металлов. Са-раскислитель сталей,бронз и других сплавов. Са используют для очистки аргона
- 17. Тест 1. Природное соединение кальция гипс отвечает формуле: а) CaCО3 б) CaSО4 в) Ca3(PО4)2 г) CaSО4
- 19. Скачать презентацию














 Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Строение атома
Строение атома Спирты
Спирты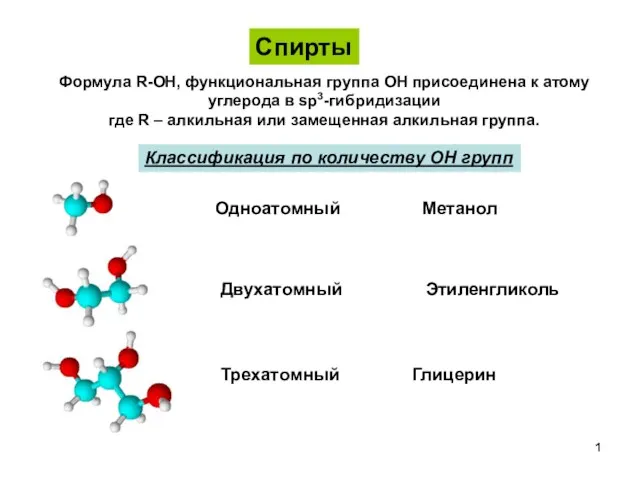 Спирты, фенолы, простые эфиры
Спирты, фенолы, простые эфиры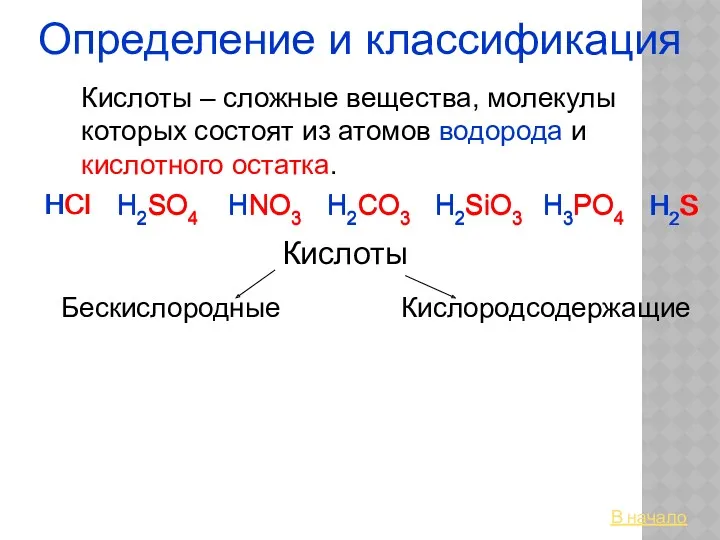 Кислоты. Определение и классификация
Кислоты. Определение и классификация Хлор. Состав. Строение
Хлор. Состав. Строение Дисперсная система
Дисперсная система Галогены. Строение атома
Галогены. Строение атома Электролиз. Области использования электролиза
Электролиз. Области использования электролиза Предмет и история геохимии
Предмет и история геохимии Простые вещества металлы
Простые вещества металлы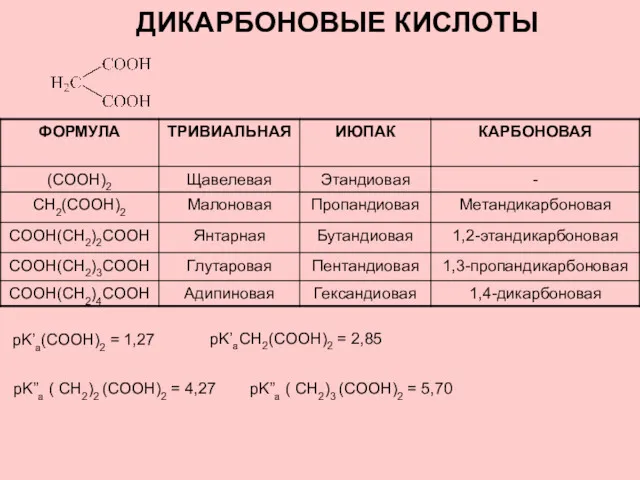 Дикарбоновые кислоты
Дикарбоновые кислоты Гидролиз органических и неорганических веществ, солей
Гидролиз органических и неорганических веществ, солей Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Аффинаж солей урана. Получение оксидов урана
Аффинаж солей урана. Получение оксидов урана Витамины. Аскорбиновая кислота
Витамины. Аскорбиновая кислота Теоретические и экспериментальные методы исследования в химии
Теоретические и экспериментальные методы исследования в химии Курс лекций: Методы диагностики и анализа микро- и наносистем
Курс лекций: Методы диагностики и анализа микро- и наносистем ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА
ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА Карбонаты. Классификация
Карбонаты. Классификация Щелочноземельные металлы
Щелочноземельные металлы Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій
Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические
Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические Выделение ферментных препаратов методами осаждения и высаливания
Выделение ферментных препаратов методами осаждения и высаливания Качественный анализ. Классификация катионов и анионов. (Лекция 2)
Качественный анализ. Классификация катионов и анионов. (Лекция 2) Качественный анализ (часть 1)
Качественный анализ (часть 1) Визитка химического элемента. Водород
Визитка химического элемента. Водород Фосфор и его соединения
Фосфор и его соединения