Содержание
- 2. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
- 3. , Строение атомов фтора и хлора + 9 F 2 7 2 7 Cl + 17
- 4. Строение атома Степени окисления: F: только -1;0 Cl, Br, I:-1; 0; +1; +3; +5; +7
- 5. Соединения хлора -1 0 +1 +3 +5 +7 HCl Cl2 Cl2O HCLO Cl2O3 HClO2 Cl2O5 HClO3
- 6. Молекулы галогенов состоят из двух атомов F2; Cl2; Br2; I2 Связь – ковалентная неполярная
- 7. Существуют только в связанном состоянии стр.172
- 8. Простые вещества - галогены
- 9. Химические свойства Сильные окислители (+е) 1. Взаимодействуют с металлами: 2Na + Cl2 = 2NaCl Zn +
- 10. Химические свойства 2. Взаимодействуют с неметаллами: Cl2 + H2 = Cl2 + S = Cl2 +
- 11. Химические свойства 3. Взаимодействуют со сложными веществами: а) с растворами солей Cl2 + 2NaI = 2NaCl
- 12. Химические свойства б) с водой 2F2 + 2H2O = 4HF + O2 Cl20 + H2O =
- 13. Химические свойства в) с растворами щелочей Cl20 + 2NaOH = NaCl-1 + NaCl+1O + H2O (без
- 14. Качественные реакции на галогенид-ионы: NaCl + AgNO3 = AgCl + NaNO3 NaBr + AgNO3 = AgBr
- 15. В промышленности: электролиз расплава или раствора хлорида натрия В лаборатории: 4 HСl + MnO2 → MnCl2
- 16. Галогеноводородные кислоты Увеличение длины связи, усиление кислотных св-в; HIр-р – самая сильная из всех известных к-т
- 18. Скачать презентацию
 Фосфор
Фосфор Реакционная способность соединений со связью углерод-гетероатом
Реакционная способность соединений со связью углерод-гетероатом The halogens
The halogens Щелочные металлы
Щелочные металлы Electrochemistry
Electrochemistry Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Биоорганикалық химия. Монофункционалды биоорганикалық қосылыстар: спирттер, альдегидтер мен кетондар
Биоорганикалық химия. Монофункционалды биоорганикалық қосылыстар: спирттер, альдегидтер мен кетондар Халық арасында тез таралатын жұқпалы ауыру түрлері,Барсакелмес қорығы
Халық арасында тез таралатын жұқпалы ауыру түрлері,Барсакелмес қорығы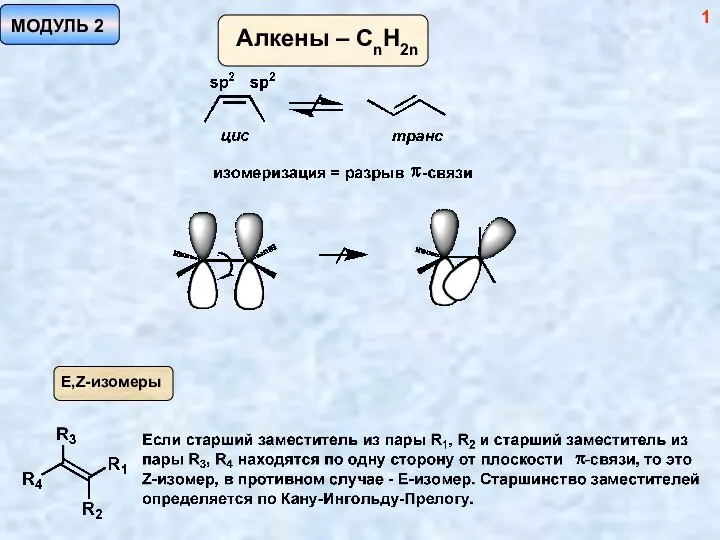 Методы синтеза алкенов. (Модуль 2)
Методы синтеза алкенов. (Модуль 2) Күкірт қышқылы
Күкірт қышқылы Атомовиты. Анатомо-физиологические свойства
Атомовиты. Анатомо-физиологические свойства Радиогеохимия метаморфических процессов
Радиогеохимия метаморфических процессов Комплексиметрическое титрование
Комплексиметрическое титрование Характеристика s,p,d,f - элементов
Характеристика s,p,d,f - элементов Сероводород, сульфиды
Сероводород, сульфиды VIIА группа: галогены
VIIА группа: галогены Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов Химический состав клетки. Неорганические вещества клетки. Урок 1
Химический состав клетки. Неорганические вещества клетки. Урок 1 Виды химической связи
Виды химической связи Углерод. Аллотропные модификации углерода
Углерод. Аллотропные модификации углерода Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Изотопная геохимия. U-Pb метод
Изотопная геохимия. U-Pb метод ФОСФОР и его соединения
ФОСФОР и его соединения Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Химические свойства солей в свете теории электролитической диссоциации
Химические свойства солей в свете теории электролитической диссоциации Қайтымды реакция. Химиялық тепе-теңдік
Қайтымды реакция. Химиялық тепе-теңдік Сложноэфирная конденсация Кляйзена-Шмидта
Сложноэфирная конденсация Кляйзена-Шмидта Основные классы химических соединений
Основные классы химических соединений