Содержание
- 2. Сделайте конспект презентации. Свойства сероводорода и уравнения химических реакций, приведенные в презентации нужно выучить. Уравнения, записанные
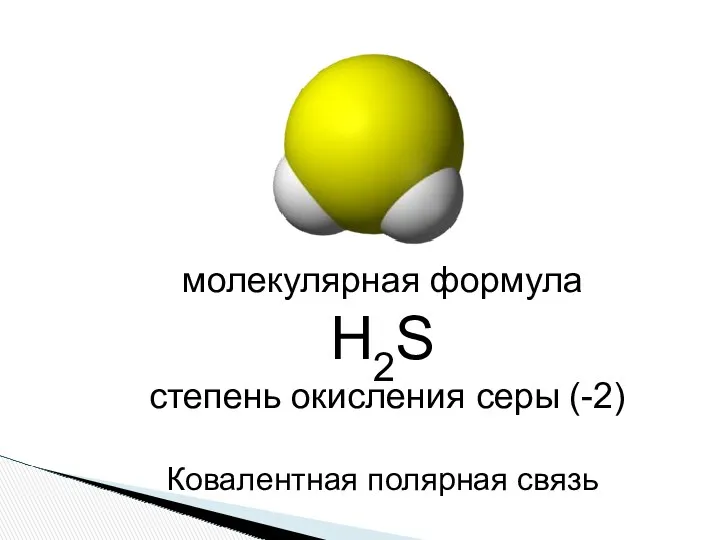
- 3. молекулярная формула Н2S степень окисления серы (-2) Ковалентная полярная связь
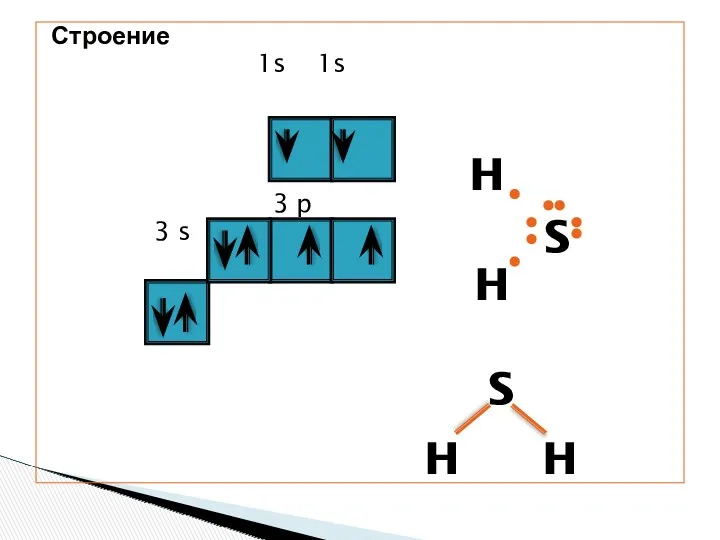
- 4. Строение 1s 1s 3 p 3 s H H S S H H
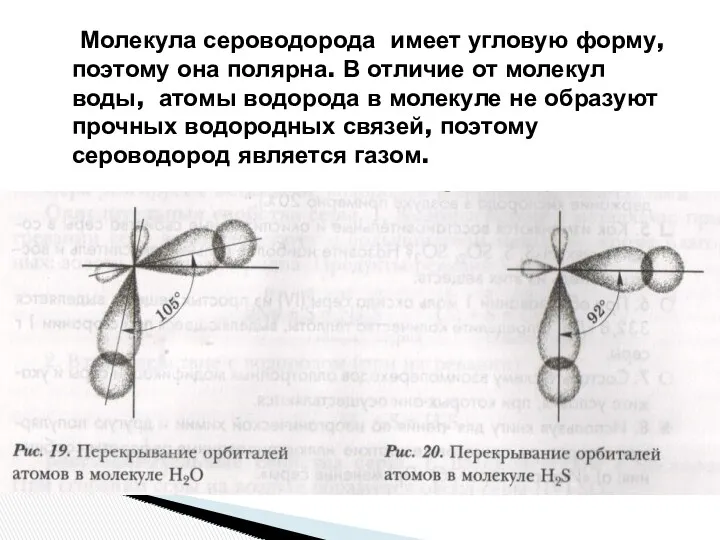
- 5. Молекула сероводорода имеет угловую форму, поэтому она полярна. В отличие от молекул воды, атомы водорода в
- 6. Нахождение в природе в свободном состоянии встречается в составе вулканических газов, во многих источниках вулканических местностей,
- 7. в растворенном и отчасти в свободном состоянии сероводород содержится в Черном море, начиная с глубины 200
- 8. в небольших количествах он образуется всюду, где происходит разложение или гниение органических веществ: она присутствует в
- 9. Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да) 1. Бесцветный газ с запахом тухлых яиц и сладковатым вкусом. 2.
- 10. 1. В лаборатории сероводород получают взаимодействием сульфида железа с соляной или разбавленной серной кислотами: FeS +
- 11. 1 ступень H2S → H+ + HS- 2 ступень HS- ↔ H+ + S2- Диссоциация по
- 12. меняют окраску индикаторов Взаимодействуют с Металлами основными и амфотерными оксидами с основаниями Солями Составьте уравнения химических
- 13. H2S + NaOH → NaHS + H2O избыток H2S + 2NaOH → Na2S + 2H2O избыток
- 14. Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV) 2H2S-2 +
- 15. Сероводород обладает свойствами восстановителя: если в пробирку с раствором сероводорода прилить небольшое количество йодной воды, то
- 16. Влияние сероводорода на окружающую среду и здоровье человека Очень токсичен. Вдыхание воздуха с содержанием сероводорода вызывает
- 17. Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная вода используются как
- 18. Сероводород применяют д для получения серной кислоты, элементной серы, сульфидов. В медицине — в составе природных
- 19. Сульфиды калия, стронция и бария используются в кожевенном деле для удаления шерсти со шкур перед их
- 22. Скачать презентацию
















 Кислоты. Растворы всех кислот
Кислоты. Растворы всех кислот Хімія та їжа
Хімія та їжа Химическая связь
Химическая связь Литий
Литий Классификация органических соединений
Классификация органических соединений Гидролиз солей
Гидролиз солей Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Кремний и его соединения
Кремний и его соединения Гідроліз солей
Гідроліз солей Периодический закон Менделеева
Периодический закон Менделеева Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Минералы. Принципы классификации минералов
Минералы. Принципы классификации минералов Лекция 6. Электрофильное присоединение к кратным связям
Лекция 6. Электрофильное присоединение к кратным связям Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Фенолы
Фенолы Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Теория строения органических соединений А.М. Бутлерова
Теория строения органических соединений А.М. Бутлерова Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів
Теорія сильних і слабких електролітів. Рівновага в розчинах малорозчинних електролітів Алюминий. Строение и свойство атомов
Алюминий. Строение и свойство атомов Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Алкадиены
Алкадиены Кремний и его соединения. Простое вещество - кристаллический кремний Si
Кремний и его соединения. Простое вещество - кристаллический кремний Si Аналитическая химия. Предмет и задачи
Аналитическая химия. Предмет и задачи Вода. Практическая работа
Вода. Практическая работа Спирти
Спирти Электролитическая диссоциация. Вещества в растворах
Электролитическая диссоциация. Вещества в растворах Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление