Содержание
- 3. Строение атома кремния
- 4. Строение атома Положение в ПС: период III; группа IV, главная; Заряд ядра: +14 Si; Относительная атомная
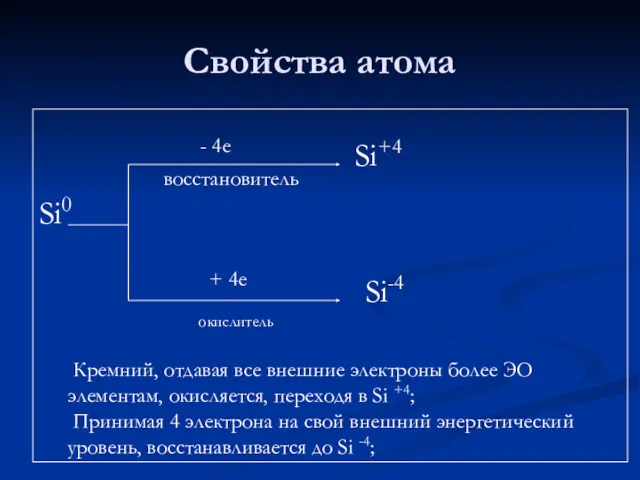
- 5. Свойства атома Si0 - 4е восстановитель + 4е окислитель Si+4 Si-4 Кремний, отдавая все внешние электроны
- 7. Физические свойства кремния Кремний – неметалл, существует в кристаллическом и аморфном состоянии. Кристаллический кремний – вещество
- 8. Кристаллическая структура кремния Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза. Но из-за большей длины связи между
- 9. Электрофизические свойства Элементарный кремний — типичный полупроводник. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся
- 10. Кремний в природе Кремний в свободном виде в природе не встречается. Кремний – второй по распространенности
- 11. Кремень Кремень, именно этот невзрачный и очень прочный камень, положил начало каменному веку – веку кремневых
- 12. Разновидности минералов на основе оксида кремния Агат Горный хрусталь Кварц Цитрин Кошачий глаз Аметист Яшма Сердолик
- 13. Знаете ли вы, что… В чистом виде кремний был выделен в 1811 году французскими учеными: Жозеф
- 14. Знаете ли вы, что.. Кремний в элементарном состоянии был впервые получен в 1825 году шведским химиком
- 15. Знаете ли вы, что… Русское название «кремний» введено в 1834 г. российским химиком Германом Ивановичем Гессом.
- 16. Знаете ли вы, что.. Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым. Кремний в
- 17. Получение кремния В промышленности кремний получают восстанавливая расплав SiO2 коксом при t = 18000C в дуговых
- 18. Получение кремния Лабораторный способ получения: SiO2 + 2 Mg ? 2MgO + Si
- 19. Химические свойства кремния Химически кремний малоактивен. При комнатной температуре реагирует только c фтором, образуя летучий тетрафторид
- 20. Химические свойства кремния При нагревании до 400 – 5000С кремний реагирует с кислородом с образованием диоксида
- 21. Химические свойства кремния с хлором, бромом и йодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4:
- 22. Химические свойства кремния При взаимодействии с металлом, кремний проявляет себя как окислитель. При взаимодействии образуются: силициды.
- 23. Химические свойства кремния С водородом кремний непосредственно не реагирует. Водородное соединение силан, получают косвенным способом, при
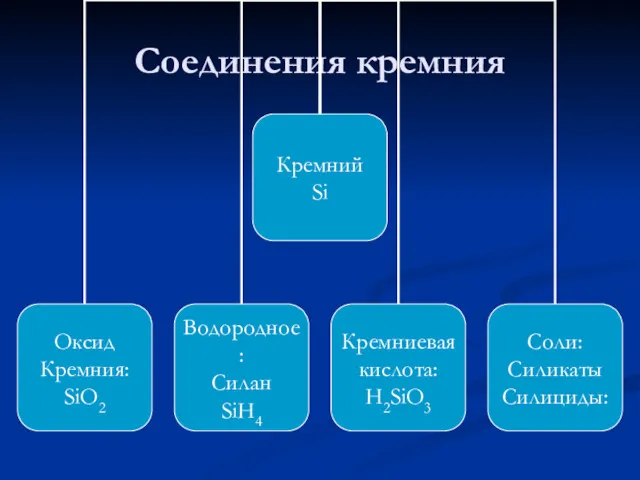
- 24. Соединения кремния
- 25. Свойства оксида
- 26. Свойства кислот
- 27. Соли
- 28. Применение кремния и его соединений Стекло Цемент Кирпич Фарфор Фаянс Клей Силикон Асбест Гранит Керамика
- 29. Применение кремния в технике
- 30. Применение кремния в медицине
- 31. Биологическая роль Важнейшее соединение кремния – SiO2 необходим для жизни растений и животных. Благодаря ему тростники,
- 32. Биологическая роль Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как
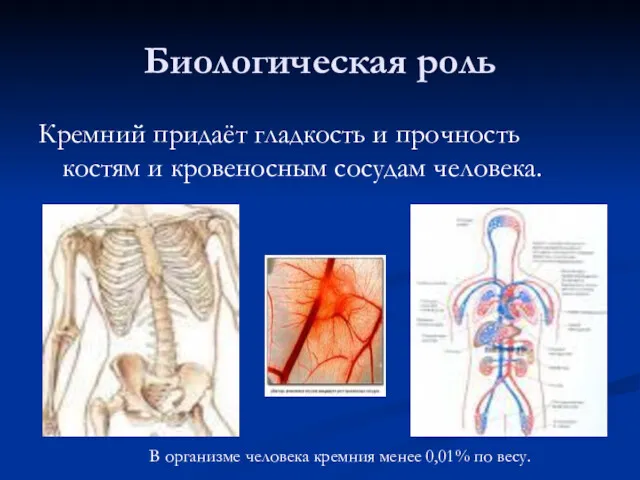
- 33. Биологическая роль Кремний придаёт гладкость и прочность костям и кровеносным сосудам человека. В организме человека кремния
- 34. Кремний - микроэлемент, постоянно содержащийся в организме человека. Наибольшее его количество содержится в лимфоузлах, соединительной ткани
- 35. Биологическая роль Кремний входит и в состав низших живых организмов – диатомовых водорослей и радиолярий, -
- 37. Скачать презентацию






























 Гетероциклические соединения. Пятичленные гетероциклы
Гетероциклические соединения. Пятичленные гетероциклы Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі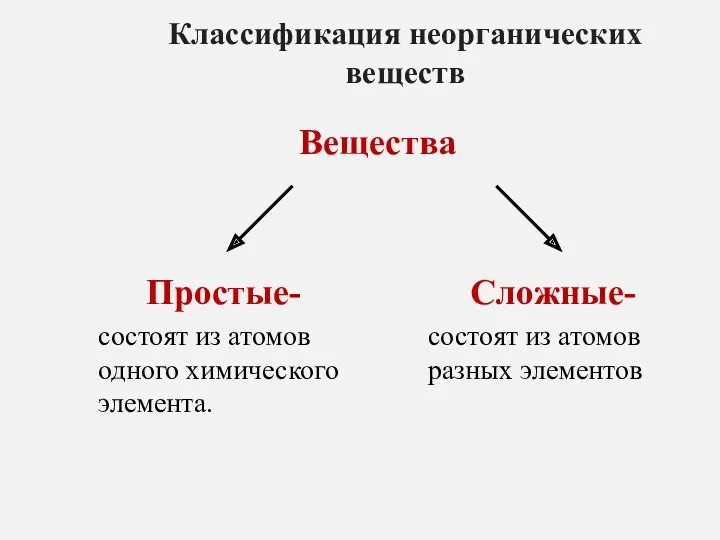 Классификация неорганических веществ
Классификация неорганических веществ Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Дисперсные системы. Свойства коллоидных растворов
Дисперсные системы. Свойства коллоидных растворов Общая характеристика неметаллов
Общая характеристика неметаллов Полімери, Їх властивості та застосування
Полімери, Їх властивості та застосування Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Непредельные углеводороды
Непредельные углеводороды Кафедра химической технологии лекарственных веществ (ХТЛВ)
Кафедра химической технологии лекарственных веществ (ХТЛВ) Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Спекание. Основные типы спекания
Спекание. Основные типы спекания Век пластмасс
Век пластмасс Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Дендример, или арборол
Дендример, или арборол Химия в быту
Химия в быту Хімія і здоров'я людини
Хімія і здоров'я людини Электронный помощник по химии (8 класс)
Электронный помощник по химии (8 класс)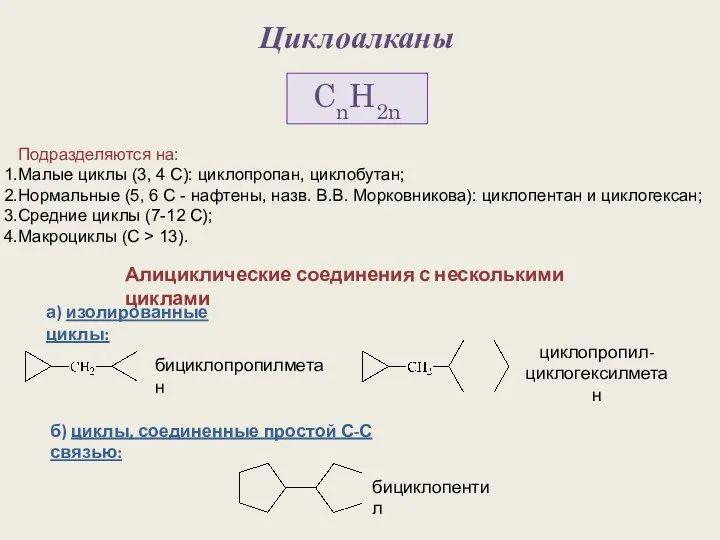 Циклоалканы. Строение алициклов
Циклоалканы. Строение алициклов Химический элемент железо
Химический элемент железо Алканы: общая формула, состав, гомологический ряд
Алканы: общая формула, состав, гомологический ряд Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Выращивание кристалла медного купороса
Выращивание кристалла медного купороса Типы химических соединений, номенклатура, свойства
Типы химических соединений, номенклатура, свойства Vitaminele
Vitaminele