Содержание
- 2. Спектроскопические методы
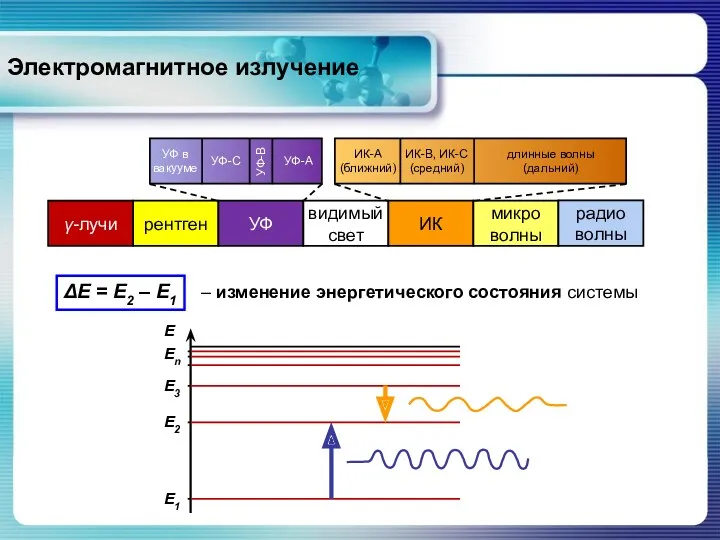
- 3. Электромагнитное излучение
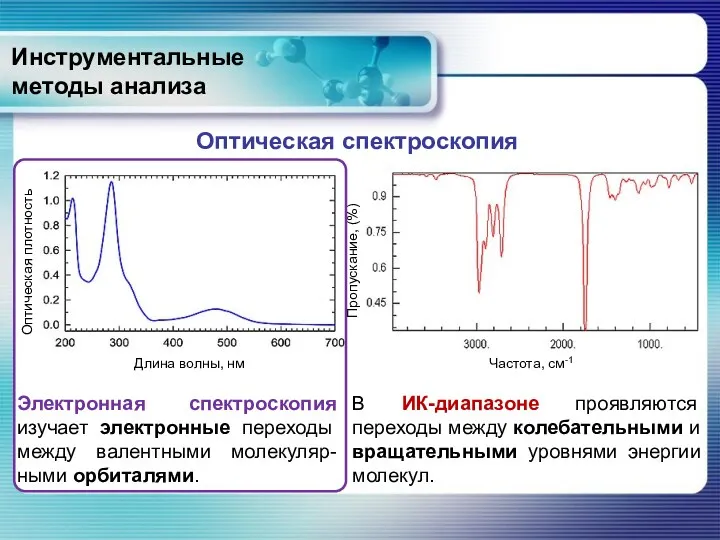
- 4. Инструментальные методы анализа Электронная спектроскопия изучает электронные переходы между валентными молекуляр-ными орбиталями. В ИК-диапазоне проявляются переходы
- 5. Оптическая спектроскопия – УФ (часть 2)
- 6. УФ спектроскопия Ультрафиолетовая (электронная) спектроскопия – раздел оптической спектроскопии, который включает получение, исследование и применение спектров
- 7. УФ спектроскопия Электронные переходы σ→σ*, π→π*, n→σ*, n→π* E = hν = hc/λ ΔE (σ→σ*) >
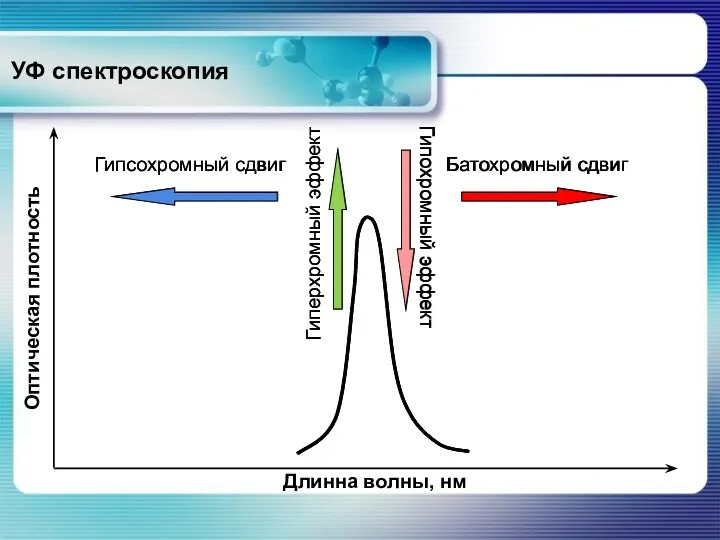
- 8. УФ спектроскопия Гипсохромный сдвиг Батохромный сдвиг Гиперхромный эффект Гипохромный эффект
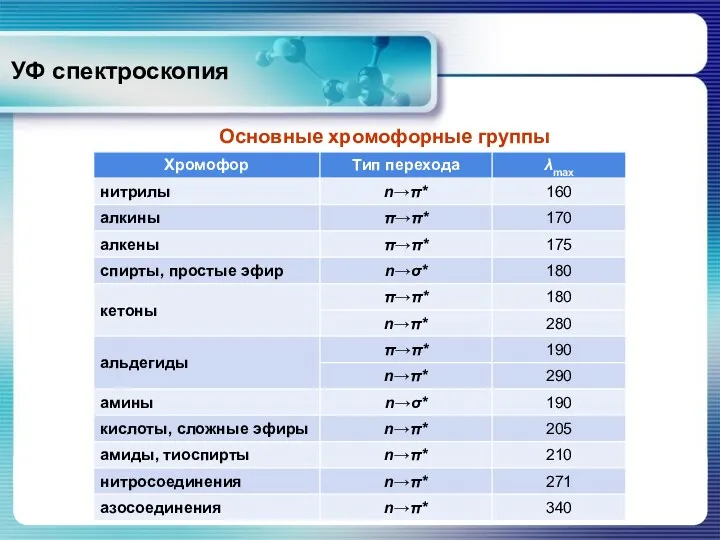
- 9. УФ спектроскопия Основные хромофорные группы
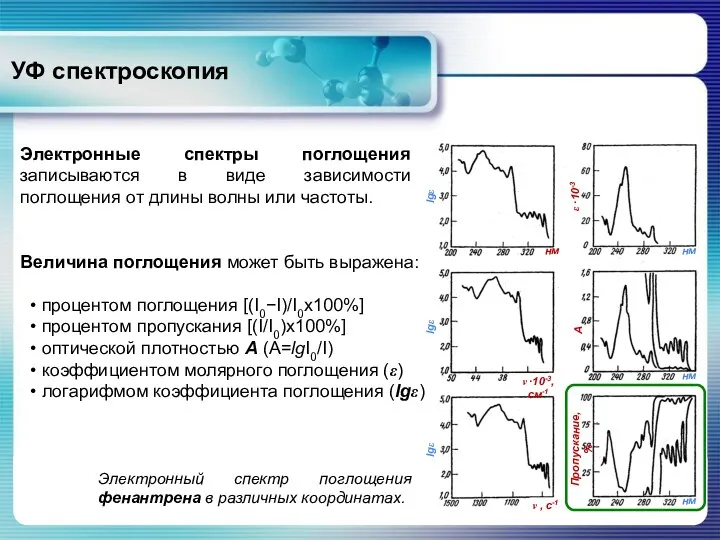
- 10. УФ спектроскопия Электронные спектры поглощения записываются в виде зависимости поглощения от длины волны или частоты. Величина
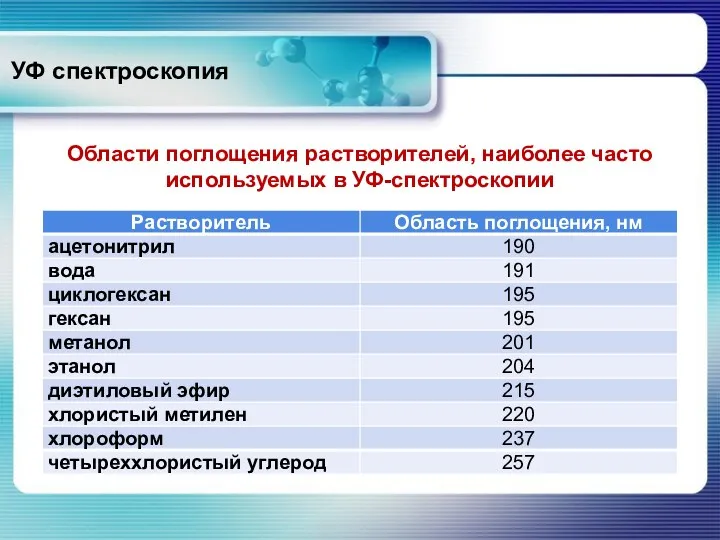
- 11. УФ спектроскопия Области поглощения растворителей, наиболее часто используемых в УФ-спектроскопии
- 12. УФ спектроскопия Электронные переходы σ→σ* Электронные переходы σ→σ* имеют наибольшую энергию и характерны для всех классов
- 13. УФ спектроскопия Электронные переходы n→σ* Электронные переходы n→σ* имеют меньшую энергию, чем σ→σ* переходы. Большинство полос
- 14. УФ спектроскопия Электронные переходы π→π* Электронные переходы π→π* можно наблюдать в спектрах всех ненасыщенных органических соединений.
- 15. УФ спектроскопия Электронные переходы π→π* Для электронной спектроскопии большее значение имеют π→π* электронные переходы в молекулах
- 16. 230 237 238 244 λ, нм диэтиловый эфир этанол метанол вода УФ спектроскопия
- 17. УФ спектроскопия Электронные переходы π→π* К типичным хромофорам, для которых характерны π→π* переходы, относятся ароматические системы.
- 18. УФ спектроскопия Электронные переходы n→π* Электронные переходы n→π* наблюдаются в спектрах соединений, в структуре которых несущий
- 19. УФ спектроскопия Электронные переходы n→π* Переходы n→π* имеют наименьшую энергию из всех видов электронных переходов. Полосы
- 20. 305 312 315 326 327 λ, нм гексан диэтиловый эфир этанол метанол вода УФ спектроскопия
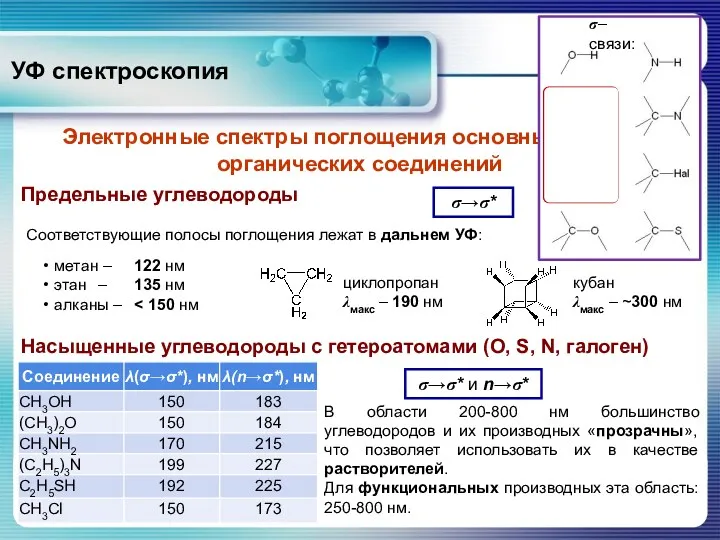
- 21. Электронные спектры поглощения основных классов органических соединений Предельные углеводороды σ→σ* Соответствующие полосы поглощения лежат в дальнем
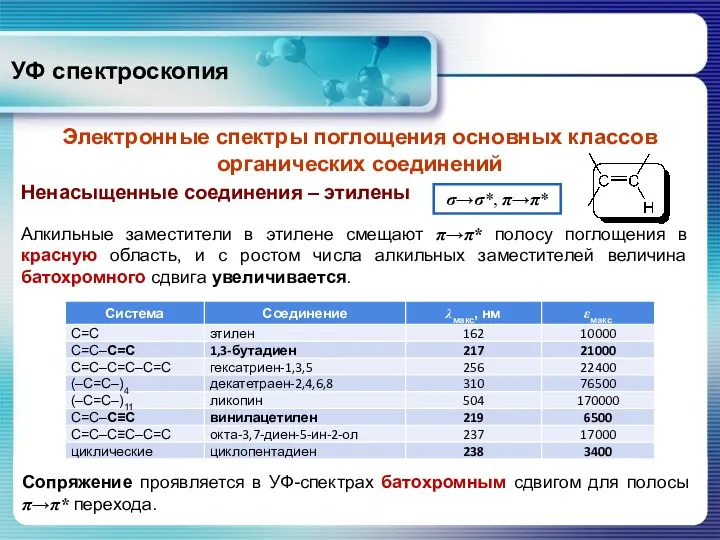
- 22. Алкильные заместители в этилене смещают π→π* полосу поглощения в красную область, и с ростом числа алкильных
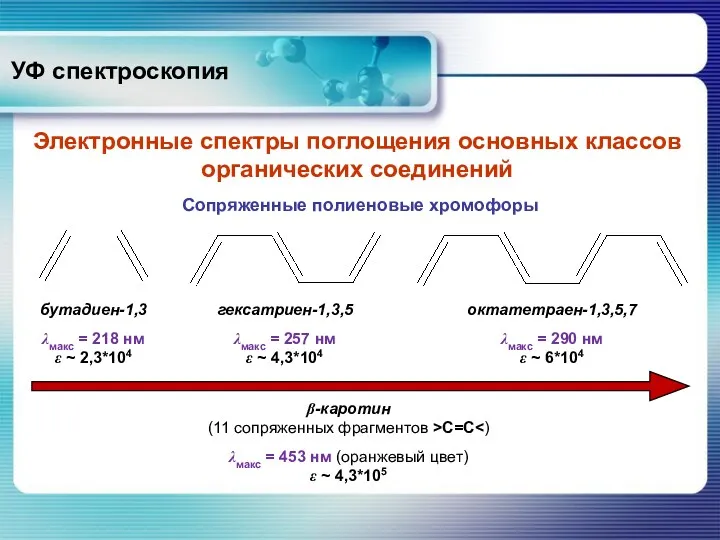
- 23. УФ спектроскопия Электронные спектры поглощения основных классов органических соединений Сопряженные полиеновые хромофоры β-каротин (11 сопряженных фрагментов
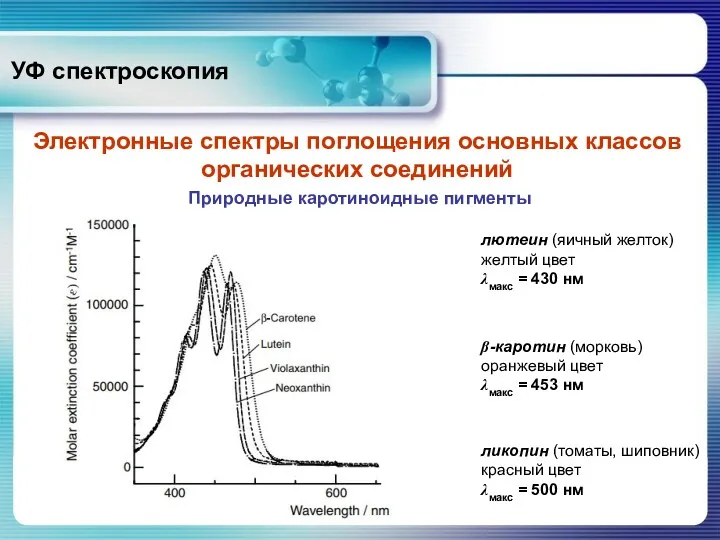
- 24. УФ спектроскопия Электронные спектры поглощения основных классов органических соединений Природные каротиноидные пигменты
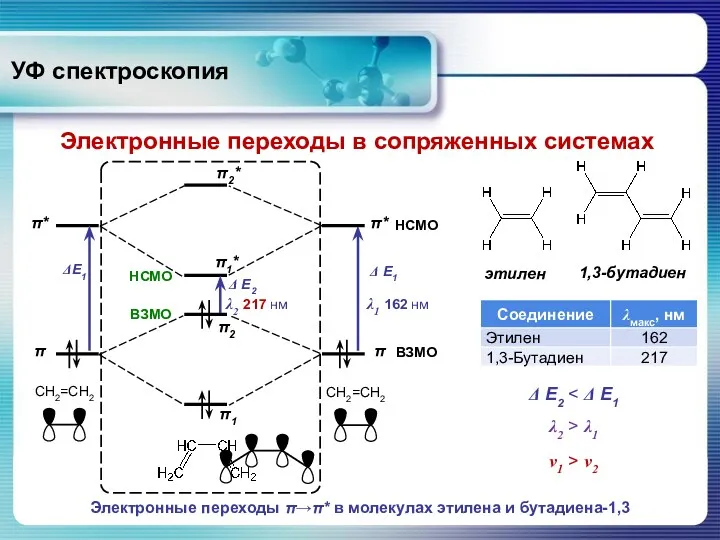
- 25. УФ спектроскопия Электронные переходы в сопряженных системах Электронные переходы π→π* в молекулах этилена и бутадиена-1,3 Δ
- 26. Ненасыщенные соединения УФ спектроскопия Электронные спектры поглощения основных классов органических соединений Зависимость положения полос поглощения сопряженных
- 27. УФ спектроскопия Правила Вудворда-Физера λмакс = λ0 + Σλi Правила Вудворда-Физера представляют собой аддитивную схему, в
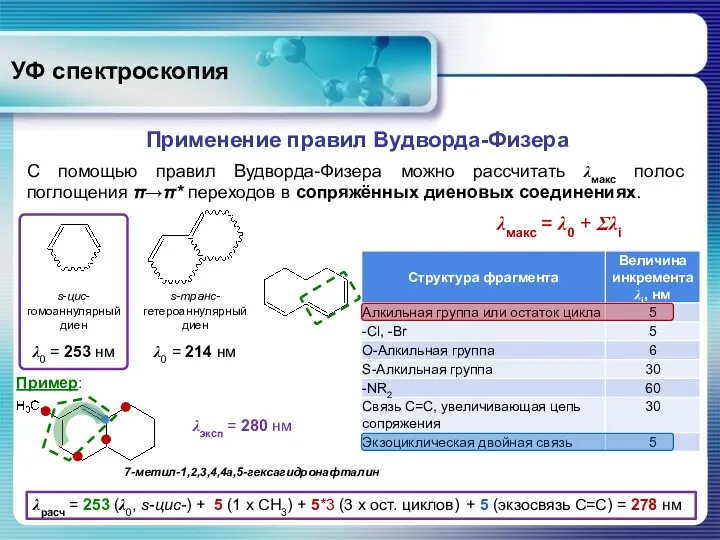
- 28. УФ спектроскопия Применение правил Вудворда-Физера λмакс = λ0 + Σλi С помощью правил Вудворда-Физера можно рассчитать
- 29. Ненасыщенные соединения – ацетилены Для ацетиленовых углеводородов с изолированной С≡С связью наблюдается полоса поглощения π→π* перехода.
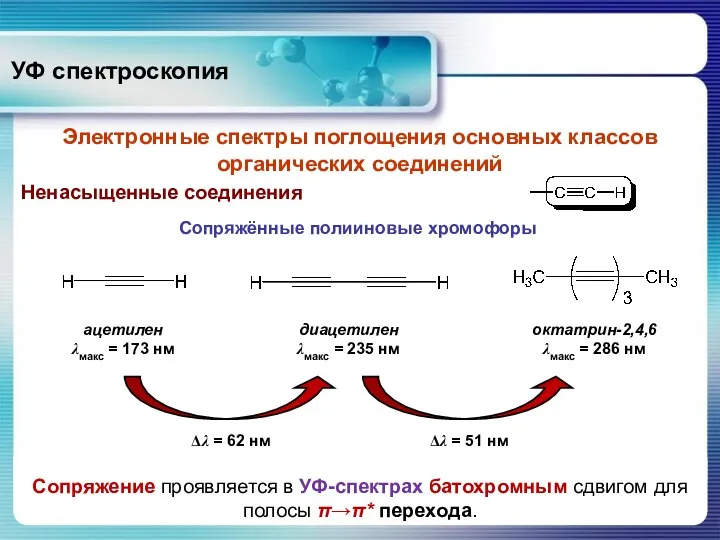
- 30. Ненасыщенные соединения УФ спектроскопия Электронные спектры поглощения основных классов органических соединений Сопряжённые полииновые хромофоры Сопряжение проявляется
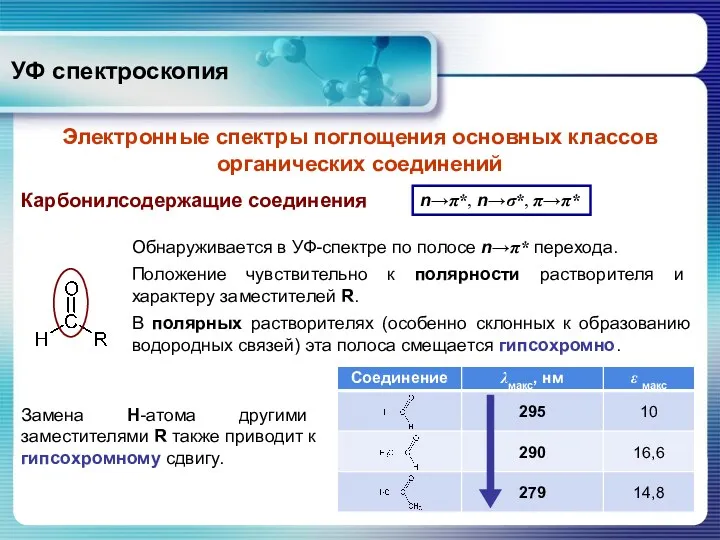
- 31. Карбонилсодержащие соединения n→π*, n→σ*, π→π* Обнаруживается в УФ-спектре по полосе n→π* перехода. Положение чувствительно к полярности
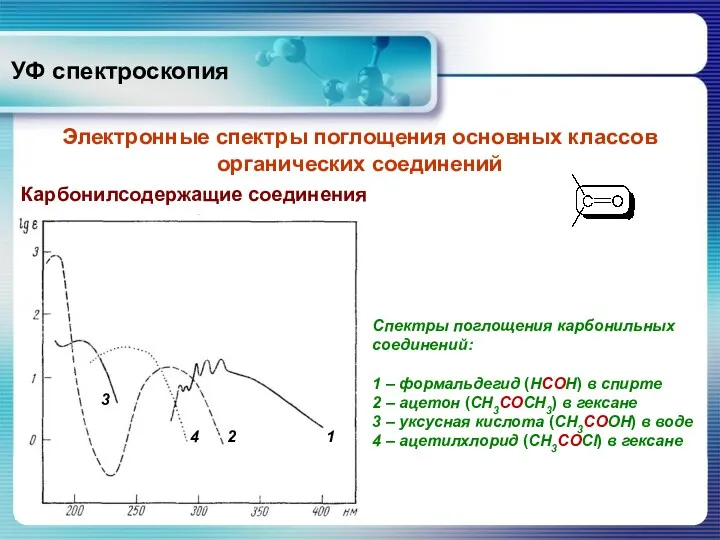
- 32. Карбонилсодержащие соединения УФ спектроскопия Электронные спектры поглощения основных классов органических соединений
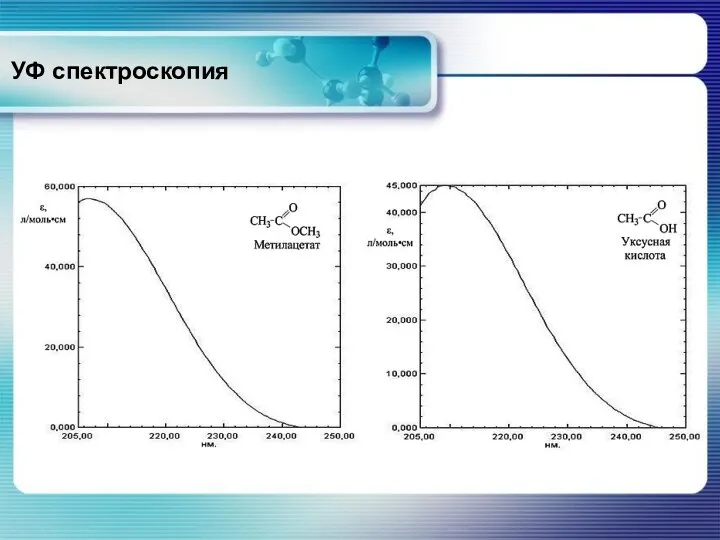
- 33. УФ спектроскопия
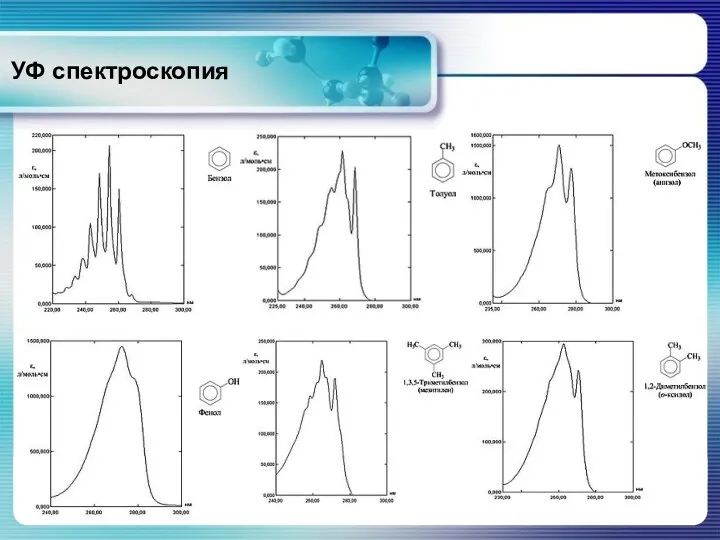
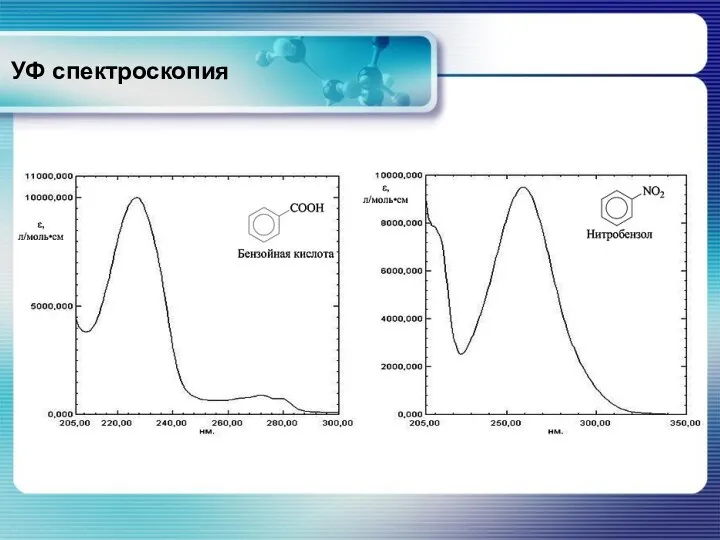
- 34. Ароматические соединения На положение полосы поглощения значительное влияние оказывают заместители и растворители. Влияния заместителей на положение
- 35. УФ спектроскопия Ароматические соединения Электронные спектры поглощения основных классов органических соединений Алкильные заместители приводят к незначительному
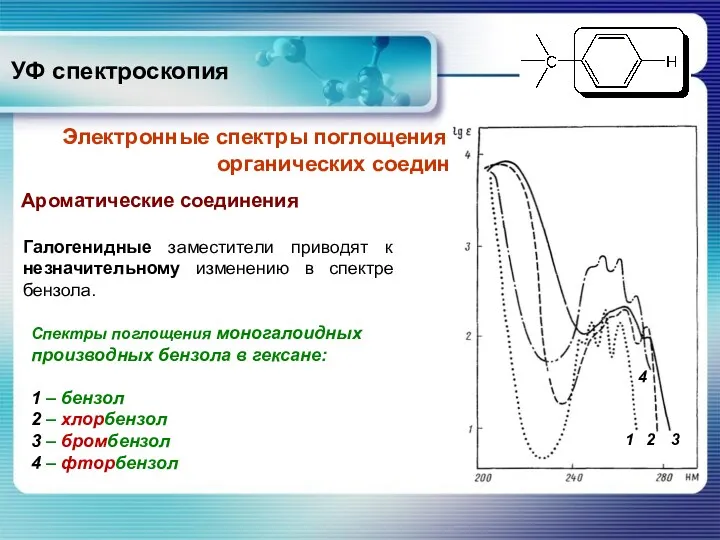
- 36. УФ спектроскопия Ароматические соединения Электронные спектры поглощения основных классов органических соединений Галогенидные заместители приводят к незначительному
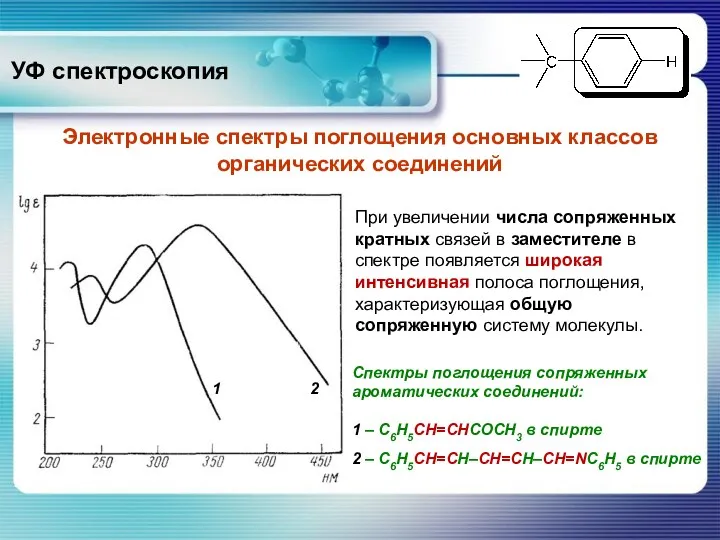
- 37. УФ спектроскопия Электронные спектры поглощения основных классов органических соединений При увеличении числа сопряженных кратных связей в
- 38. УФ спектроскопия
- 39. УФ спектроскопия
- 40. УФ спектроскопия Использование УФ-спектров при исследовании органических соединений При практическом использовании спектров поглощения для структурных исследований
- 41. УФ спектроскопия Монохроматор – прибор, используется для пространственного разделения света различных длин волн Кювета – изготавливается
- 42. УФ спектроскопия УФ-лампы для спектрофотометра
- 43. УФ спектроскопия Монохроматор дифракционная решетка CaF2, LiF, кварц, стекто
- 44. УФ спектроскопия Монохроматоры для работы в вакуумном УФ-диапазоне спектра
- 45. УФ спектроскопия Кюветы для спектрофотометра
- 46. УФ спектроскопия Детекторы
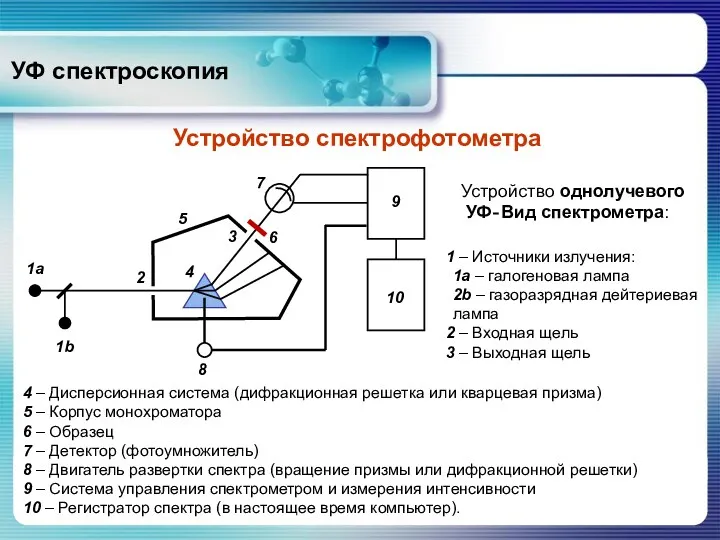
- 47. УФ спектроскопия Устройство спектрофотометра 4 – Дисперсионная система (дифракционная решетка или кварцевая призма) 5 – Корпус
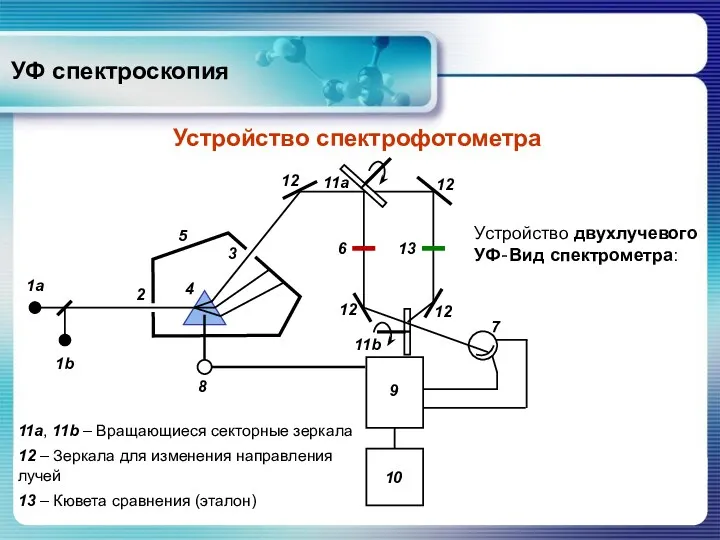
- 48. УФ спектроскопия Устройство спектрофотометра 11a, 11b – Вращающиеся секторные зеркала 12 – Зеркала для изменения направления
- 49. УФ спектроскопия Спектрофотометр для работы в УФ и видимом диапазоне спектра Спектрофотометр СФ-46
- 50. УФ спектроскопия Спектрофотометр для работы в УФ и видимом диапазоне спектра
- 51. УФ спектроскопия Спектрофотометр для работы в УФ и видимом диапазоне спектра
- 52. УФ спектроскопия УФ спектрофотометр ПЭ-5400УФ
- 53. УФ спектроскопия УФ спектрофотометр LEKI SS2109UV
- 54. УФ спектроскопия Спектрофотометр двухлучевой для работы в УФ и видимом диапазоне спектра Shimadzu UV-1800
- 55. УФ спектроскопия УФ-спектрофотометр Evolution 600
- 56. УФ спектроскопия УФ-спектрофотометр PerkinElmer Lambda 35 в ИрИХ СО РАН
- 57. Задача. Рассчитайте количество (г) бензола в 100 л этанольного раствора, если известны следующие характеристики электронного спектра
- 58. Решение. С увеличением полярности растворителя максимум полосы поглощения n→π* перехода смещается в коротковолновую область (гипсохромный сдвиг).
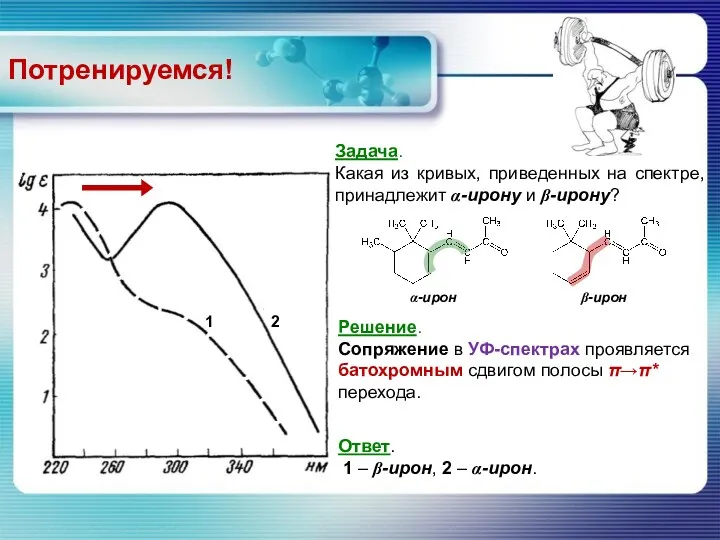
- 59. Решение. Сопряжение в УФ-спектрах проявляется батохромным сдвигом полосы π→π* перехода. Потренируемся! Ответ. 1 – β-ирон, 2
- 60. Решение. С удлинением сопряженной цепи полосы поглощения смещаются в длинноволновую область и их интенсивность возрастает. Самая
- 61. Задача: На рисунке приведены спектры поглощения фенола в растворе гексана, спирта и щелочном растворе. Определите, какому
- 63. Скачать презентацию





































 Биосенсорные системы
Биосенсорные системы Комплексные соединения
Комплексные соединения Тест по неорганической химии
Тест по неорганической химии Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Химические реакции
Химические реакции Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості Шестая группа элементов
Шестая группа элементов Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Кристаллизация
Кристаллизация Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) Химическая связь в кристаллах
Химическая связь в кристаллах Осадительное титрование
Осадительное титрование Дисперсні системи
Дисперсні системи Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ)
Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ) Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций становление органической химии
становление органической химии Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Поширення металів у природі
Поширення металів у природі Воспламенение (зажигание) газовых смесей
Воспламенение (зажигание) газовых смесей Химическая связь
Химическая связь Материаловедение и технология обработки материалов
Материаловедение и технология обработки материалов Товары бытовой химии
Товары бытовой химии Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Катализ кислотами и основаниями. Лекция 3
Катализ кислотами и основаниями. Лекция 3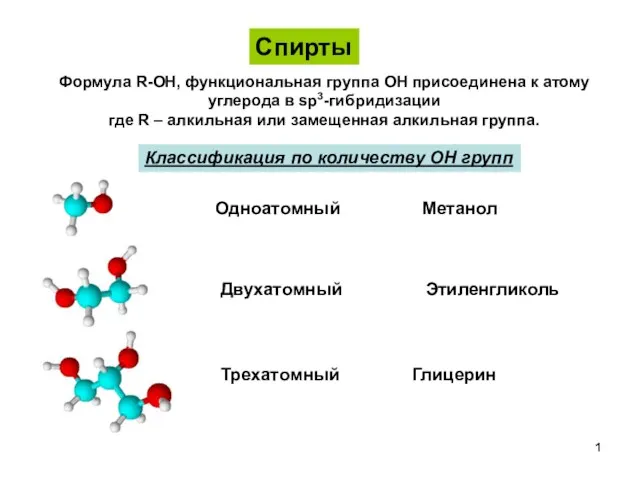 Спирты, фенолы, простые эфиры
Спирты, фенолы, простые эфиры