Содержание
- 2. Кислород Химия 8 класс
- 3. План Общая характеристика Нахождение в природе История открытия Физические свойства Получение
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА «КИСЛОРОД» Химический знак Положение в ПСХЭ (указать период, группа, порядковый номер) Относительная атомная
- 5. Химический знак - О Положение в ПСХЭ период II, группа VIА, порядковый номер 8 Относительная атомная
- 6. Кислород как элемент В земной коре его 49% по массе, в гидросфере – 89% по массе.
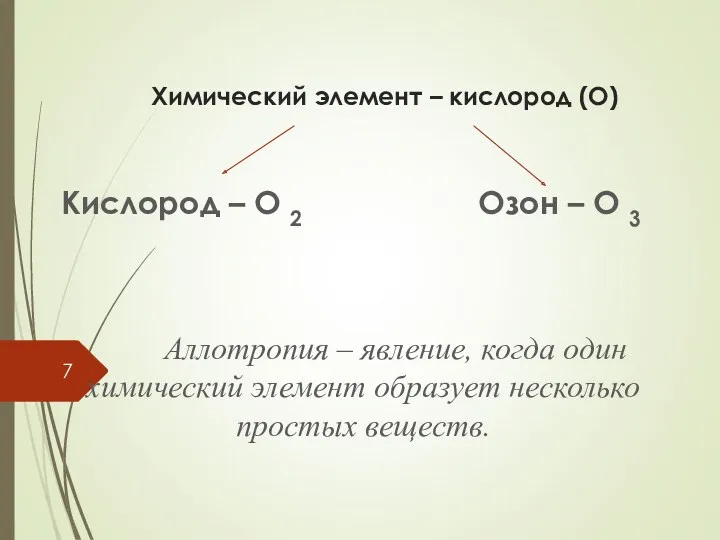
- 7. Химический элемент – кислород (О) Кислород – О 2 Озон – О 3 Аллотропия – явление,
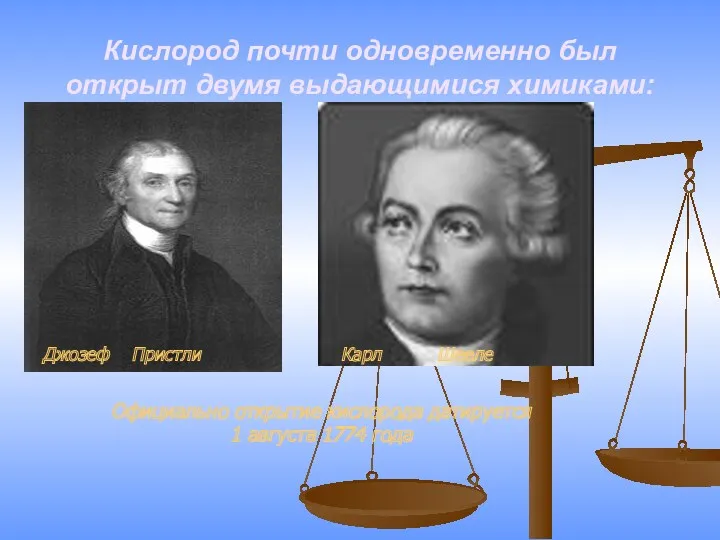
- 8. Кислород почти одновременно был открыт двумя выдающимися химиками: Джозеф Пристли Карл Шееле Официально открытие кислорода датируется
- 9. оксюс – «кислый» генао – «рождаю» Современное название кислороду дал Антуан Лавуазье
- 10. Физические свойства Газ - без цвета, вкуса и запаха; мало растворим в воде t°кип= -183°С; t°пл
- 11. Получение кислорода В лаборатории кислород чаще всего получают из перманганата калия (KMnO4), пероксида водорода (H2O2) и
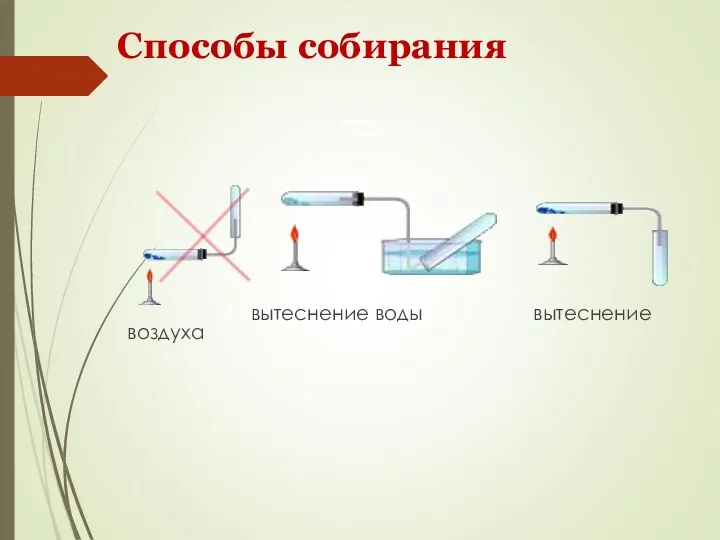
- 12. Способы собирания вытеснение воды вытеснение воздуха
- 13. Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne
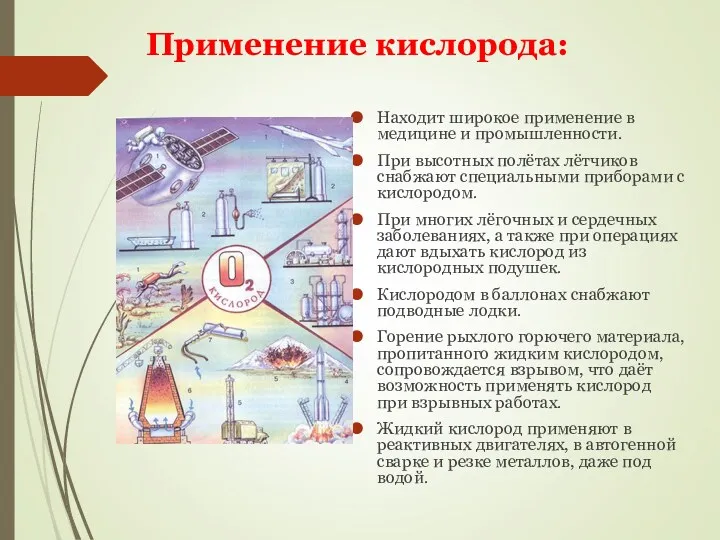
- 14. Находит широкое применение в медицине и промышленности. При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- 15. По горизонтали: 1. Без него невозможно дышать 4. Химическая реакция, при которой происходит окисление веществ с
- 17. Скачать презентацию










 Количество вещества. Моль
Количество вещества. Моль Основы органической химии
Основы органической химии Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Кремний. Применение кремния
Кремний. Применение кремния Титанның химиялық элементі
Титанның химиялық элементі Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Химиядан сұрақтар
Химиядан сұрақтар Кислород. Атом кислорода
Кислород. Атом кислорода Природные источники углеводородов
Природные источники углеводородов Қатты күйдегі препараттар
Қатты күйдегі препараттар Радиусы атомов и ионов
Радиусы атомов и ионов Теорія горіння та вибуху
Теорія горіння та вибуху Химия. Изучение жиров
Химия. Изучение жиров Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Solutions and solubilities
Solutions and solubilities Хімічні сполуки у побуті
Хімічні сполуки у побуті Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Кислородсодержащие органические соединения. Спирты. 10 класс
Кислородсодержащие органические соединения. Спирты. 10 класс Химическая связь
Химическая связь Как и где используется соляная кислота
Как и где используется соляная кислота Виды химической связи
Виды химической связи Вода. Растворимость, растворы
Вода. Растворимость, растворы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты
Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты Обмоточные провода
Обмоточные провода Классификация химических реакций
Классификация химических реакций