Содержание
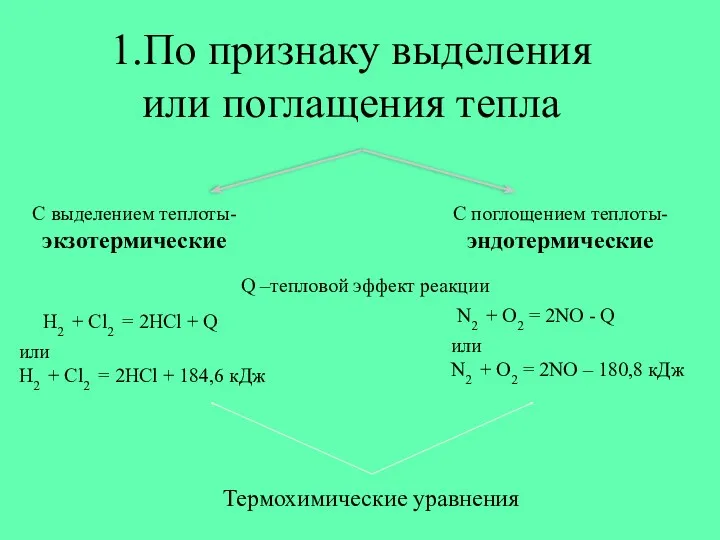
- 2. 1.По признаку выделения или поглащения тепла С выделением теплоты- экзотермические С поглощением теплоты- эндотермические Q –тепловой
- 3. Т.Х.У.- уравнение , в котором указан тепловой эффект и агрегатное состояние веществ Если теплота выделяется –
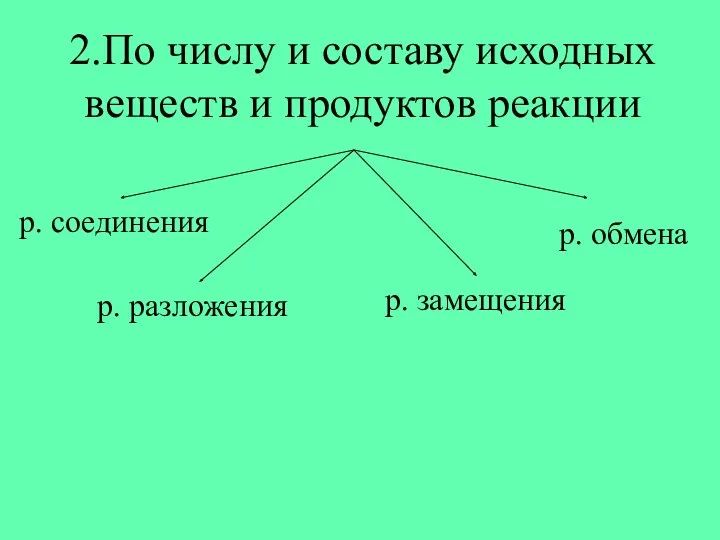
- 4. 2.По числу и составу исходных веществ и продуктов реакции.
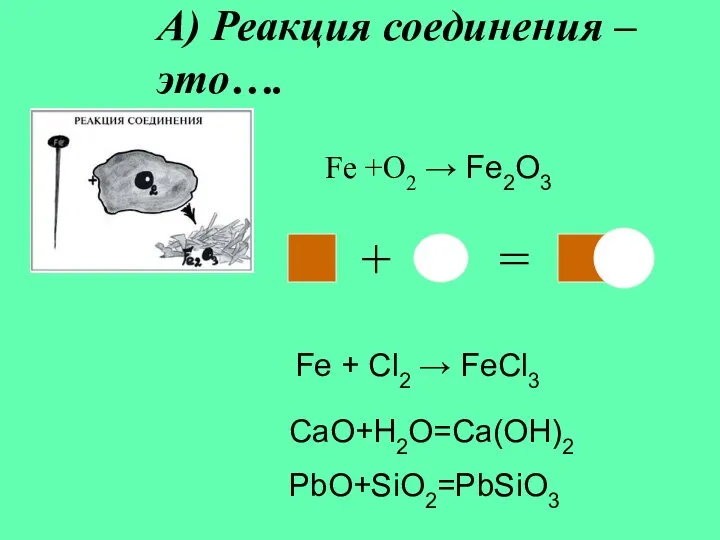
- 5. А) Реакция соединения – это…. Fe + Cl2 → FeCl3 Fe +O2 → Fe2O3 + =
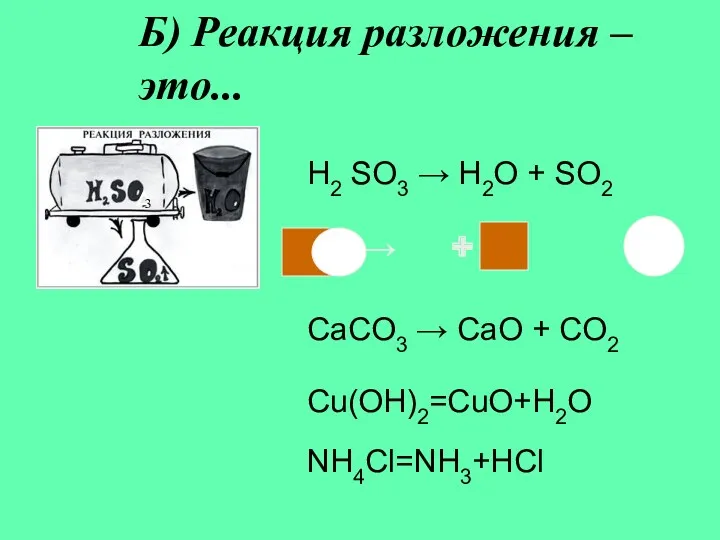
- 6. Б) Реакция разложения – это... H2 SO3 → H2O + SO2 3 → + CaCO3 →
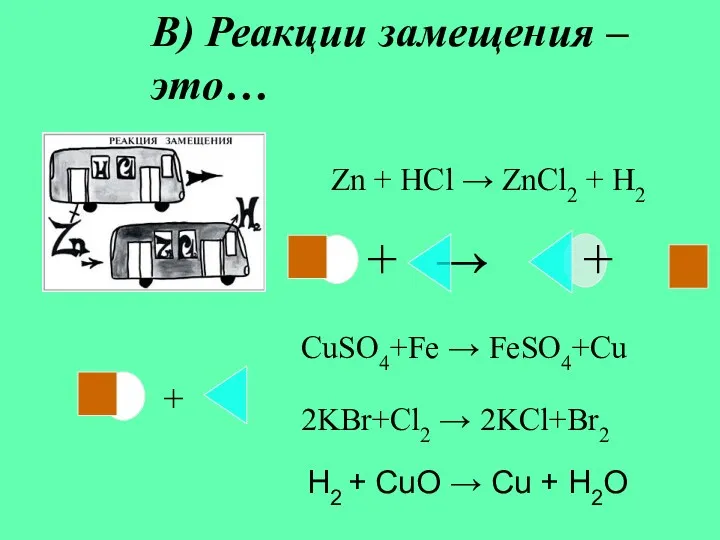
- 7. В) Реакции замещения – это… Zn + HCl → ZnCl2 + H2 + CuSO4+Fe → FeSO4+Cu
- 8. Г) Реакция обмена – это… + → + + NaOH + КCl → КOH +NaCl
- 9. 1.По признаку выделения или поглащения тепла С выделением теплоты- экзотермические С поглощением теплоты- эндотермические Q –тепловой
- 10. 2.По числу и составу исходных веществ и продуктов реакции р. соединения р. разложения р. замещения р.
- 11. Распределите реакции по их типу, расставьте коэффициенты. СuCl2 + KOH → Cu(OH)2 + KCl MgO +
- 13. Скачать презентацию





 Приёмы обращения с лабораторным оборудованием
Приёмы обращения с лабораторным оборудованием Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Основные классы неорганических веществ. Соединения химических элементов
Основные классы неорганических веществ. Соединения химических элементов Выделение транс-анетола из эфирных масел
Выделение транс-анетола из эфирных масел Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых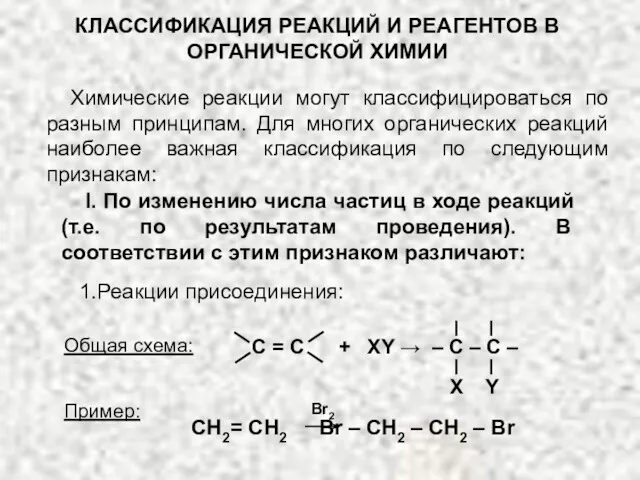 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Химическая промышленность
Химическая промышленность Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Химические свойства металлов
Химические свойства металлов Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Окислительно-восстановительные реакции. Лекция 8
Окислительно-восстановительные реакции. Лекция 8 Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Обратимость химических реакций. Химическое равновесие и способы его смещения
Обратимость химических реакций. Химическое равновесие и способы его смещения Строение атома
Строение атома Электролиз. Электролизеры
Электролиз. Электролизеры Применение уксусной кислоты
Применение уксусной кислоты Фосфор. Гипофосфатемия и гиперфосфатемия
Фосфор. Гипофосфатемия и гиперфосфатемия Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Установка по переработке углеводородов
Установка по переработке углеводородов Комплексные соединения
Комплексные соединения Физико-химические методы анализа. Лекция 3
Физико-химические методы анализа. Лекция 3 Сера. Аллотропные модификации
Сера. Аллотропные модификации Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Качественное определение химических элементов в почве
Качественное определение химических элементов в почве Аммиак
Аммиак