Содержание
- 2. NH3 – аммиак Степень окисления азота в этом соединении –3. Ковалентная полярная связь. Физические свойства: бесцветный
- 3. Химические свойства: 1. При реакции с водой начинается диссоциация: NH3 + H2O ⇄ NH4+ + OH–
- 4. Химические свойства: 4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения
- 5. Химические свойства: 7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать
- 6. Способы получения В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо
- 9. Скачать презентацию
Слайд 2
NH3 – аммиак
Степень окисления азота в этом соединении –3.
Ковалентная полярная
NH3 – аммиак
Степень окисления азота в этом соединении –3.
Ковалентная полярная
связь.
Физические свойства: бесцветный газ, с резким запахом, ядовит, хорошо растворим в воде. Водный раствор с массовой долей аммиака 3% называется нашатырный спирт; а 25% – аммиачная вода.
Физические свойства: бесцветный газ, с резким запахом, ядовит, хорошо растворим в воде. Водный раствор с массовой долей аммиака 3% называется нашатырный спирт; а 25% – аммиачная вода.
Слайд 3
Химические свойства:
1. При реакции с водой начинается диссоциация: NH3 + H2O
Химические свойства:
1. При реакции с водой начинается диссоциация: NH3 + H2O
⇄ NH4+ + OH–
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония. Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
3. В качестве основания, водный раствор аммиака реагирует с растворами солей металлов, образуя нерастворимые гидроксиды. Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония. Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
3. В качестве основания, водный раствор аммиака реагирует с растворами солей металлов, образуя нерастворимые гидроксиды. Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
Слайд 4
Химические свойства:
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака,
Химические свойства:
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака,
образуя комплексные соединения – аминокомплексы. Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак. Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак. Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
Слайд 5
Химические свойства:
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные
Химические свойства:
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные
свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества. Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота. Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота. Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Слайд 6
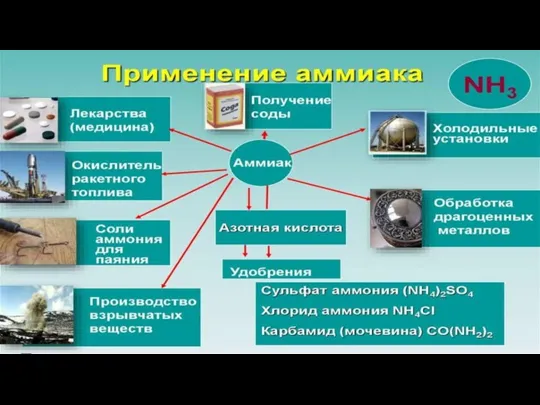
Способы получения
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку
Способы получения
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку
аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Еще один лабораторный способ получения аммиака – гидролиз нитридов. Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Еще один лабораторный способ получения аммиака – гидролиз нитридов. Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Слайд 7
- Предыдущая
Место России среди современных государствСледующая -
ЖК Воскресенское-2




 Хімічні властивості кислот
Хімічні властивості кислот Радикальные реакции. (Лекция 9)
Радикальные реакции. (Лекция 9) Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз Почему нефть называют черным золотом
Почему нефть называют черным золотом Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Производство водорода
Производство водорода Общие свойства металлов
Общие свойства металлов Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3)
Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3) Растворы электролитов и неэлектролитов. Ионное произведение воды
Растворы электролитов и неэлектролитов. Ионное произведение воды Минералы и горные породы
Минералы и горные породы Enantioselective Total Synthesis
Enantioselective Total Synthesis Основы химической термодинамики и кинетики химических реакций
Основы химической термодинамики и кинетики химических реакций Общая характеристика галогенов
Общая характеристика галогенов Алканы. Получение, свойства и применение
Алканы. Получение, свойства и применение Термодинамика химических процессов
Термодинамика химических процессов Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Свойства воды. Оценка качества
Свойства воды. Оценка качества Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Кобальт. Нахождение в природе. Получение
Кобальт. Нахождение в природе. Получение Группа галогенов в периодической системе
Группа галогенов в периодической системе Подгруппа азота
Подгруппа азота Липиды. Классификация
Липиды. Классификация Химический элемент титан
Химический элемент титан Металлы в природе. Получение
Металлы в природе. Получение Кислоты. Состав кислот
Кислоты. Состав кислот Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Гетерофункциональные соединения
Гетерофункциональные соединения