Содержание
- 2. Алканы - углеводороды с общей формулой CnH2n+2 в молекулах которых имеются только одинарные связи.
- 3. Гомологи Гомологический ряд — это ряд химических соединений, принадлежащих к одному классу веществ и отличающихся по
- 4. Гомологический ряд алканов CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22
- 5. Изомеры Изомерия — явление существования химических соединений одинаковых по качественному и количественному составу и молекулярной массе,
- 6. Номенклатура алканов 1. Выбирают наиболее длинную (главную) цепь и нумеруют ее, начиная с того конца, к
- 7. Алканы – бесцветные вещества, легче воды, плохо растворяются в воде. C5H12…C15H32 Жидкости (имеют запах) t кипения
- 8. Физические свойства метана Газ, без цвета и запаха, почти в 2 раза легче воздуха, малорастворим в
- 9. Получение 1) Восстановление галогенпроизводных (в присутствии Pd) CH3Cl + H2 → CH4 + HCl 2CH3I +
- 10. Получение метана В промышленности: а) из природного газа; б) синтез из оксида углерода (II) и водорода
- 11. Химические свойства 1) Галогенирование CH4 + Cl2 → CH3Cl (хлорметан) + HCl CH3Cl + Cl2 →
- 12. Цепная реакция Цепная реакция — химическая реакция, в которой появление свободного радикала или атома вызывает большое
- 13. NO2 CH3 CH CH3 + HNO3 CH3 C CH3 + H2O. CH3 CH3 СН3–СН3 + Сl2
- 14. Химические свойства метана 2) Горение CH4 + 2O2 → CO2 + 2H2O + Q 3) Разложение
- 15. Химические свойства метана 4) Крекинг 2CH4 → C2H2 + 3H2 — при 1500 °C 5) Нитрование
- 16. Химические свойства метана 6) Дегидрирование (t > 1500 °C, Ni) CH3-CH3 → CH2=CH2 + H2 (этан
- 17. В промышленности широко применяется каталитическое окисление алканов, в результате которого получаются разнообразные кислородосодержащие соединения: спирты, карбоновые
- 18. Реакции разложения алканов При сильном нагревании без доступа воздуха происходит полное разложение алканов на простые вещества.
- 19. Запомни! Предельные углеводороды не вступают в реакции присоединения. Для них характерны реакции замещения, окисления и разложения.
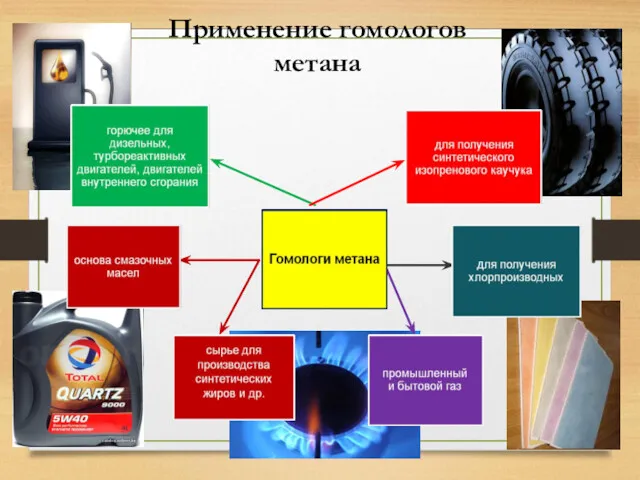
- 20. Применение гомологов метана
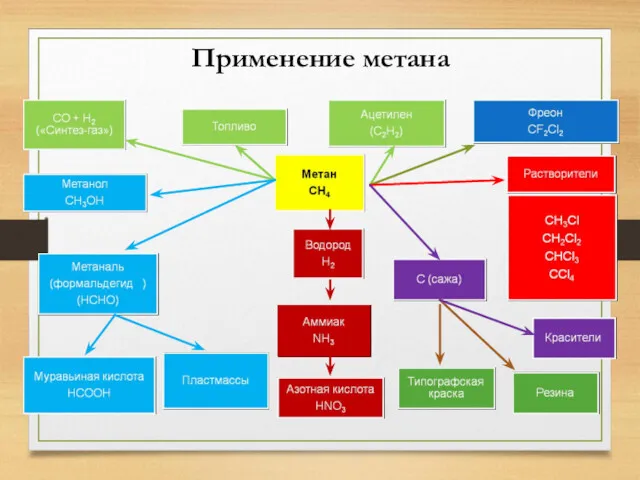
- 21. Применение метана
- 22. Решите цепочку превращений C → CH4 → CH3Cl →C2H6→ C2H5Cl
- 24. Скачать презентацию



















 Полимеры
Полимеры Лекция 8.3. Реакции окисления и восстановления органических соединений
Лекция 8.3. Реакции окисления и восстановления органических соединений Неорганика. Подготовка к ЕГЭ-2020
Неорганика. Подготовка к ЕГЭ-2020 Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Білки як високомолекулярні сполуки
Білки як високомолекулярні сполуки Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал
Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Чистые вещества и смеси
Чистые вещества и смеси Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки Химическая связь
Химическая связь Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Кислоты в животном и растительном мире
Кислоты в животном и растительном мире Аммиак. Соли аммония
Аммиак. Соли аммония Полифункциональные органические соединения
Полифункциональные органические соединения Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические
Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические Практическая работа № 3. Получение, собирание и распознавание газов
Практическая работа № 3. Получение, собирание и распознавание газов Химические средства гигиены и косметики
Химические средства гигиены и косметики Колебания кристаллической решетки и ее тепловые свойства. Тепловые свойства
Колебания кристаллической решетки и ее тепловые свойства. Тепловые свойства Растворы
Растворы Реакции ионного обмена
Реакции ионного обмена Учение о растворах
Учение о растворах Элементы термодинамики. Кинетика химических реакций
Элементы термодинамики. Кинетика химических реакций Химия. Химиялық термодинамика
Химия. Химиялық термодинамика Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Вода. Химические и физические свойства
Вода. Химические и физические свойства