Содержание
- 2. Химия – түрлі жүйелердегі, соның ішінде тірі ағзадағы да процестерді зерттеу мен түсіну үшін қажетті инструмент
- 3. Термодинамикалық жүйе – қоршаған ортадан шынайы не шартты түрде бөлінген, бір немесе өзара әрекеттесуші бірнеше денелер
- 4. Жүйе күйі: Термодинамикалық тепе-теңдік күйі – уақыт аралығындағы жүйе қасиеттерінің кез-келген нүктедегі тұрақтылығы, энергия және зат
- 5. Термодинамикалық тұрғыдан тірі ағза: стационарлық күйде болатын ашық гетерогенді термодинамикалық жүйе Тірі ағзаға тән: Жүйе параметрлерінің
- 6. Ішкі энергия (U) –жүйенің жалпы энергия қоры, жүйе бөлшектерінің өзара әрекеттесуі мен қозғалыстарының барлық түрін құрайды
- 7. Энтальпия (Н) –изобарлы-изотермиялық жағдайдағы жүйенің энергиясын сипаттайтын жүйе күйінің функциясы. Ол ішкі энергия мен жұмыстың қосындысына
- 8. Химиялық реакция қай бағытта өздігінен жүру керек? Өздігінен жүретін процесс – сыртқы факторлардың әсерінсіз жүретін термодинамикалық
- 9. Егер процесс кезінде ретсіздік өзгермесе (ΔS = 0), онда процестің бағыты энтальпияның өзгерісімен анықталады және процесс
- 10. Дж. Гиббс (1839-1903) Процестердің өздігінен жүру шарты ретінде екі фактордың да (энтальпия және энтропия) әсерін ескеретін
- 11. Процестің өздігінен жүру мүмкіндігінің шарттары: Процесс өздігінен жүреді dG 0) Процесс өздігінен жүрмейді dG>0 (dH>0, dS
- 12. Пригожин принципі: Стационарлық күйдегі термодинамикалық ашық жүйеде қайтымсыз процестердің жүру барысындағы энтропияның пайда болу жылдамдығының мәні
- 13. Химиялық кинетика химиялық реакциялардың жылдамдығын; химиялық реакциялардың жүру механизмін; реакция жылдамдығының түрлі факторларға тәуелділігін зерттейтін ғылыми
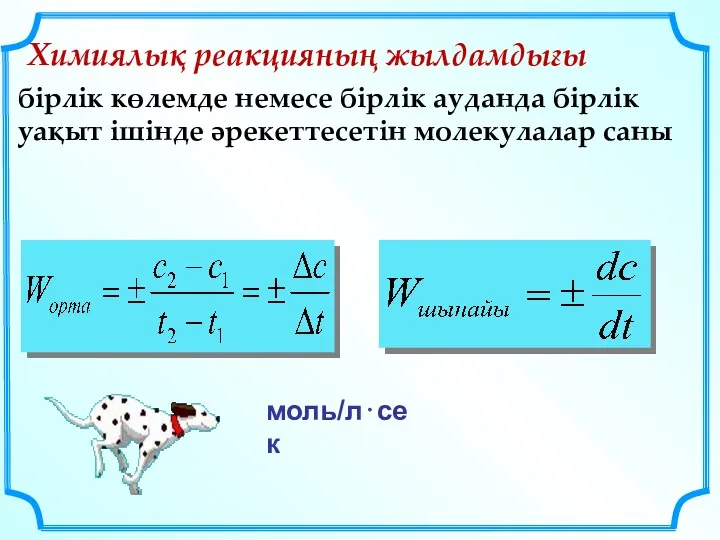
- 14. Химиялық реакцияның жылдамдығы бірлік көлемде немесе бірлік ауданда бірлік уақыт ішінде әрекеттесетін молекулалар саны моль/л⋅сек
- 15. Жәй (бірсатылы) реакциялар Мономолекулалық А өнім I2 2I Тримолекулалық 2NO(г) + H2(г) N2O(г) + H2O(г) Бимолекулалық
- 16. Химиялық реакцияның жылдамдығына әсер етуші факторлар: әрекеттесуші заттардың табиғаты; әрекеттесуші заттардың концентрациясы; температура; катализатордың қатысы
- 17. әрекеттесуші заттардың табиғаты (молекулалар, иондар, атомдар, радикалдар) Химиялық реакцияның жылдамдығына әсер етуші факторлар
- 18. Концентрация: Әрекеттесуші заттар концентрациясының артуымен реакция жылдамдығы артады Берілген температурада, химиялық реакцияның жылдамдығы, стехиометриялық коэффициенттері дәреже
- 19. Массалар әрекеттесуші заңы n = a + b + d – реакцияның жалпы реті aA +
- 20. Вант-Гофф теңдеуі Температураны әрбір 10 градусқа көтергенде реакция жылдамдығы 2-4 есе артады Биореакциялар үшін қолданылмайды γ
- 21. КАТАЛИЗ Оң катализ Теріс катализ Катализдің негізгі заңдылықтары Каt тек қана ТД мүмкін реакцияларды ғана жылдамдатады
- 22. Ферментативті катализ Катализдіің жалпы заңдылықтары сақталынады! Ферменттердің катализатор ретіндегі негізгі ерекшеліктері: өте жоғары каталитикалық активтілігі; субстратқа
- 23. Ферменттердің каталитикалық активтілік көрсету шарттары Температураның жоғары болмауы; рН мәндерінің шағын аумағы; Қысымның тұрақты болуы.
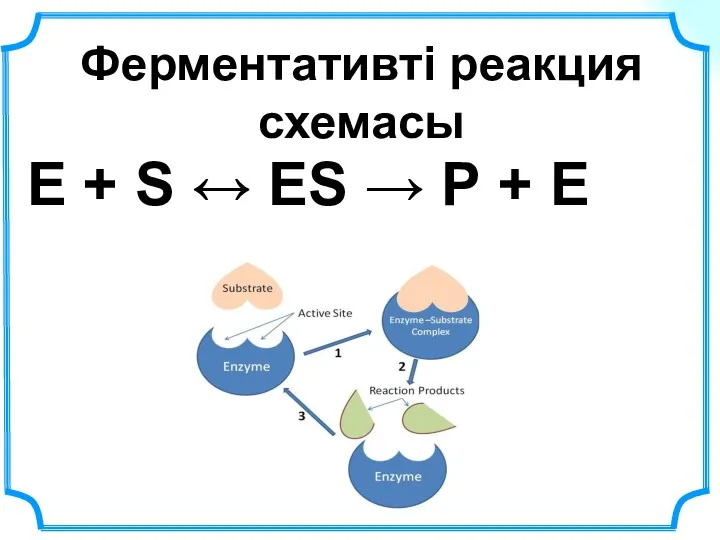
- 24. Ферментативті реакция схемасы Е + S ↔ ЕS → Р + Е
- 25. Михаэлис-Ментен теңдеуі
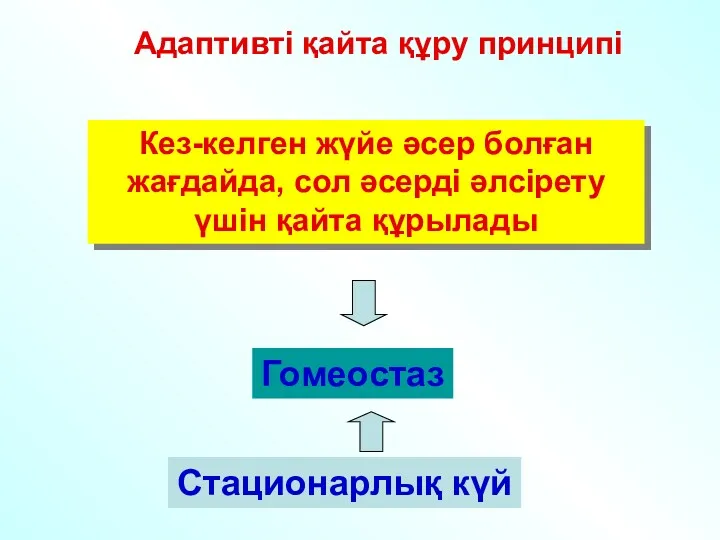
- 26. Адаптивті қайта құру принципі Кез-келген жүйе әсер болған жағдайда, сол әсерді әлсірету үшін қайта құрылады Гомеостаз
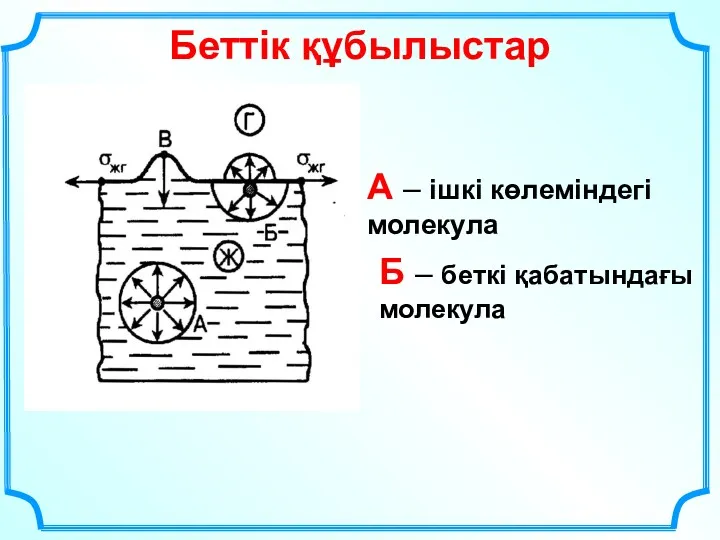
- 27. Беттік құбылыстар А – ішкі көлеміндегі молекула Б – беткі қабатындағы молекула
- 28. Адсорбция –еріген зат концентрациясының фазалардың бөліну бетінде өздігінен өзгере жүретін процесс Адсорбент – бет қабатында адсорбция
- 29. Хроматография Біреуі – қозғалмайтын, ал екіншісі – қозғалатын өзара араласпайтын екі фаза арасында заттардың таралуына негізделген,
- 30. Хроматографияның артықшылықтары Талдауды орындау жылдамдығы Жоғары сезімталдығы (10-8 %-ға дейін) Талданатын заттың химиялық өзгеріске ұшырап кетпеуі
- 31. Хроматографиялық әдістердің биология және медицинада қолданылуы: кейбір патологияларда, биологиялық сұйықтықтарда пайда болатын микрокомпоненттерді анықтау; допинг-бақылауды жүргізу;
- 33. Скачать презентацию

























 Хімічні формули речовин
Хімічні формули речовин Водород
Водород Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Материаловедение промышленного производства. Особенности строения твердых тел
Материаловедение промышленного производства. Особенности строения твердых тел Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника
Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника Химия в Великую Отечественную войну
Химия в Великую Отечественную войну Массовая доля вещества в растворе
Массовая доля вещества в растворе Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Современные химические технологии
Современные химические технологии Каталитический риформинг
Каталитический риформинг Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2) Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Простые вещества
Простые вещества Незвичайна вода
Незвичайна вода Фазовое равновесие
Фазовое равновесие Химия в повседневной жизни человека
Химия в повседневной жизни человека Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Химические свойства карбокатионов
Химические свойства карбокатионов Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Скорость химических реакций
Скорость химических реакций