Содержание
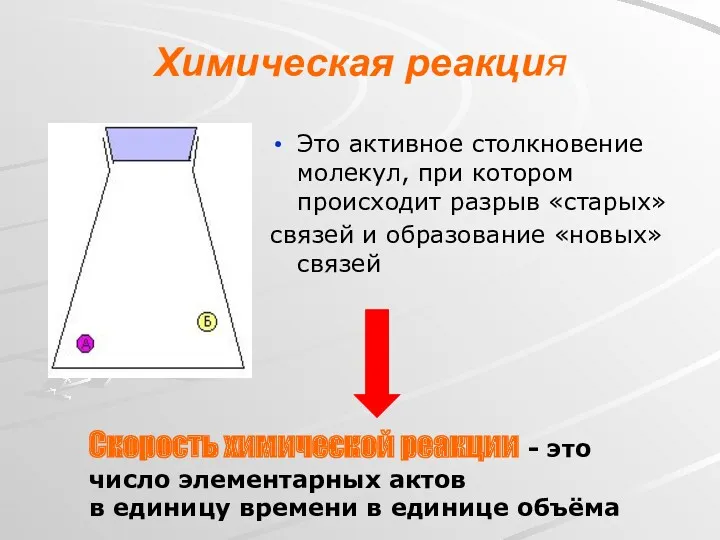
- 2. Химическая реакция Это активное столкновение молекул, при котором происходит разрыв «старых» связей и образование «новых» связей
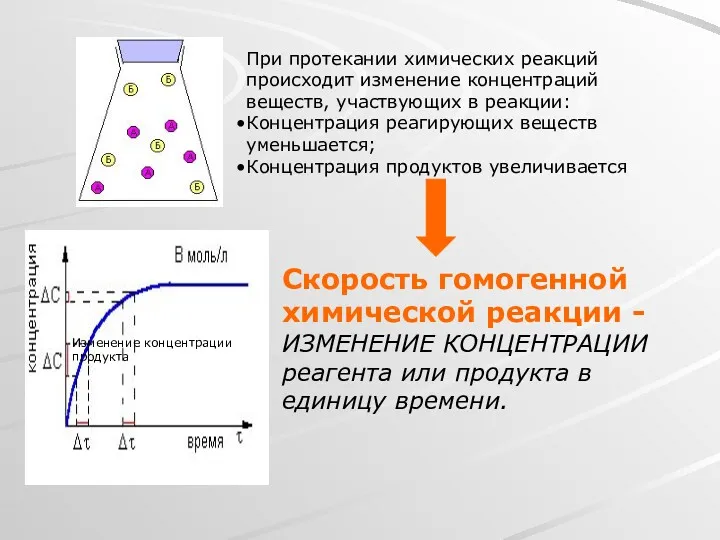
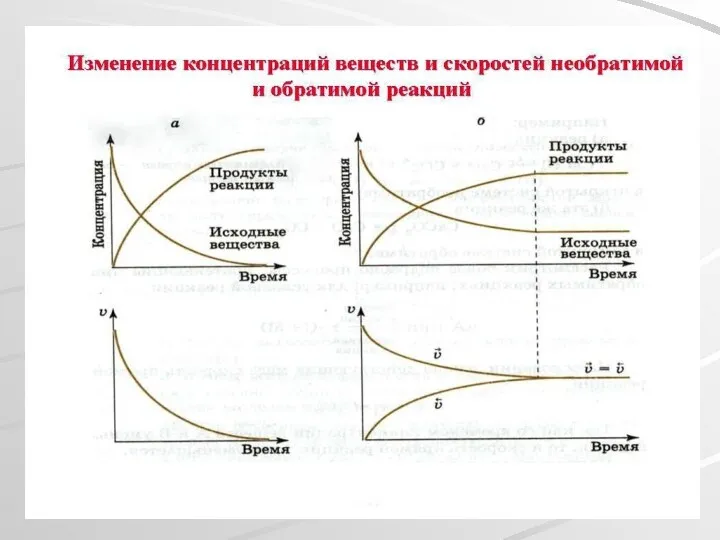
- 3. При протекании химических реакций происходит изменение концентраций веществ, участвующих в реакции: Концентрация реагирующих веществ уменьшается; Концентрация
- 4. Формулы для расчета скорости реакции
- 5. Химическая реакция протекает в растворе, согласно уравнению: А+В=С Исходная концентрация: вещества А – 0,80 моль/л. Через
- 6. Решение: Дано: С(А) = 0,80 моль/л; С(А1) = 0,74 моль/л; Δt = 20 минут. Найти: Vгомог.=?
- 7. Факторы, влияющие на скорость реакции Природа реагирующих веществ Площадь поверхности твердого вещества Концентрация реагирующих веществ Температура
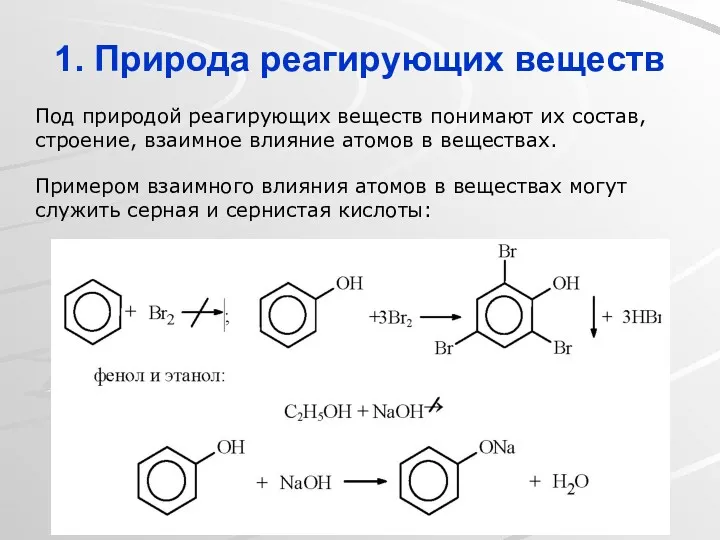
- 8. 1. Природа реагирующих веществ Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в
- 9. 2. Площадь поверхности твердого вещества Если в реакции кроме жидкости (или газа) участвуют твердые вещества, площадь
- 10. 3. Концентрация реагирующих веществ Чем больше концентрация реагирующих веществ, тем больше скорость химической реакции. Закон действующих
- 11. 4. Влияние температуры Правило Вант-Гоффа: При повышении температуры на каждые 10 градусов скорость реакций увеличивается в
- 12. 5. Катализатор Катализаторами называются вещества, которые влияют на скорость реакции, но сохраняют свой химический состав. Изменение
- 13. Закон действующих масс Н.И. Бекетов Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях
- 14. Теория активации Выводы: 1. Повышение температуры усиливает скорость движения молекул, увеличивая тем самым число столкновений между
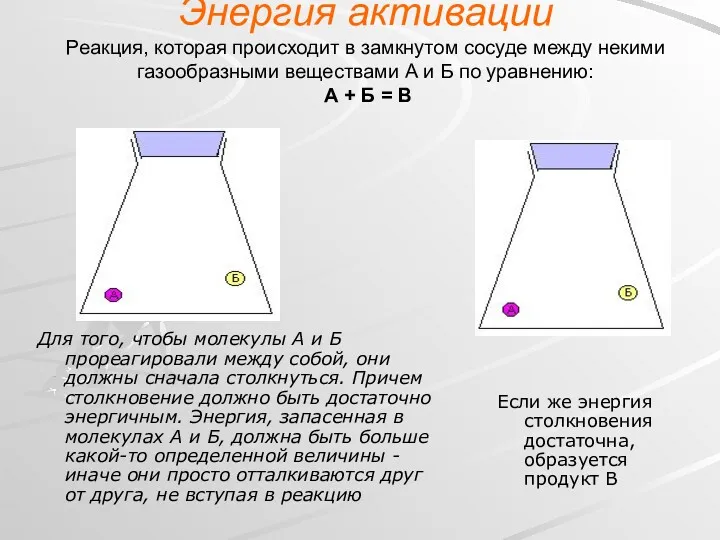
- 15. Энергия активации Реакция, которая происходит в замкнутом сосуде между некими газообразными веществами А и Б по
- 16. Примеры химических реакций Необратимые х.р. Na2SO4 +BaCl2 ? BaSO4 ↓+ 2NaCl Zn(OH)2 +2HCl ? ZnCl2 +
- 17. Химическое равновесие Обратимая химическая реакция H2 + I2 ↔ 2HI По закону действующих масс Vпр.=k₁ [H2]∙[I2]
- 19. Переход системы из одного состояния равновесия в другое называется смещением химического равновесия. Правило смещения химического равновесия
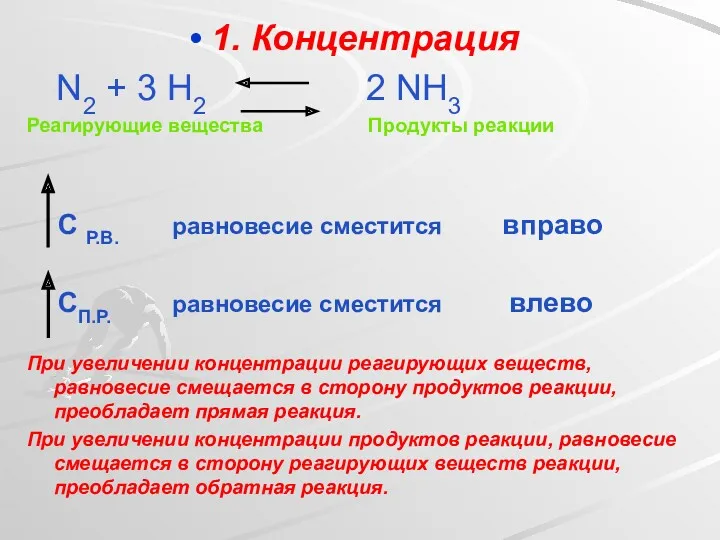
- 20. 1. Концентрация N2 + 3 H2 2 NH3 Реагирующие вещества Продукты реакции С Р.В. равновесие сместится
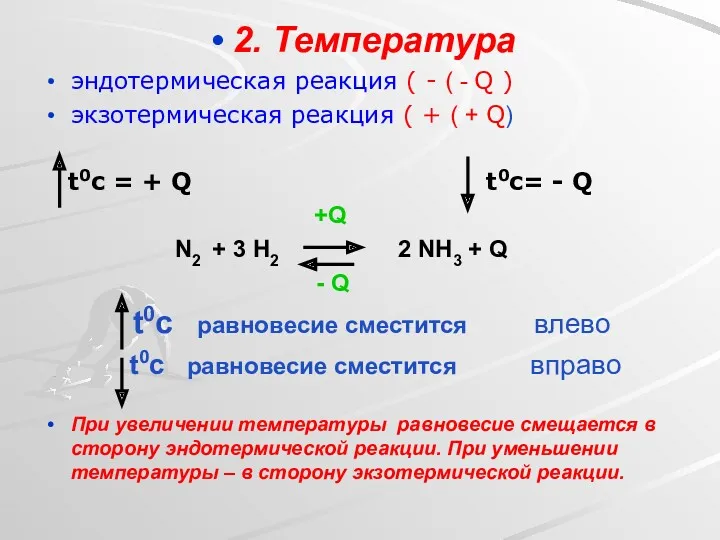
- 21. 2. Температура эндотермическая реакция ( - ( - Q ) экзотермическая реакция ( + ( +
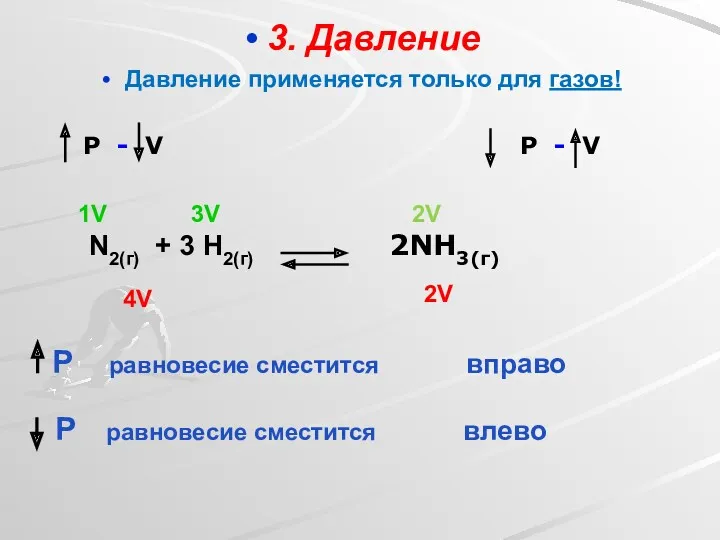
- 22. 3. Давление Давление применяется только для газов! P - V P - V 4V 2V N2(г)
- 23. При увеличения давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов уменьшается.
- 25. Скачать презентацию














 Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Строение атома
Строение атома Спирты
Спирты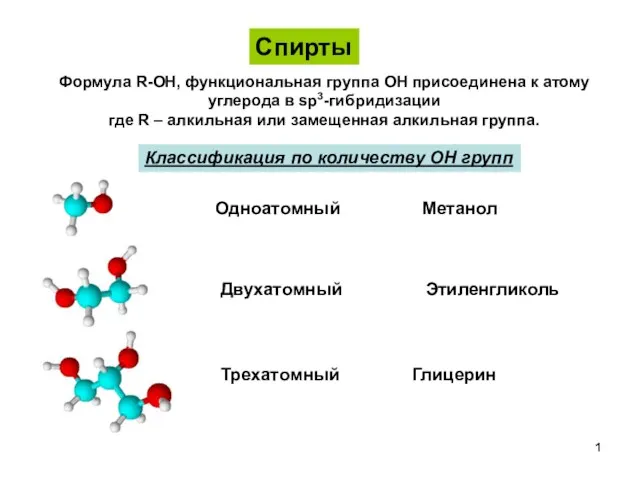 Спирты, фенолы, простые эфиры
Спирты, фенолы, простые эфиры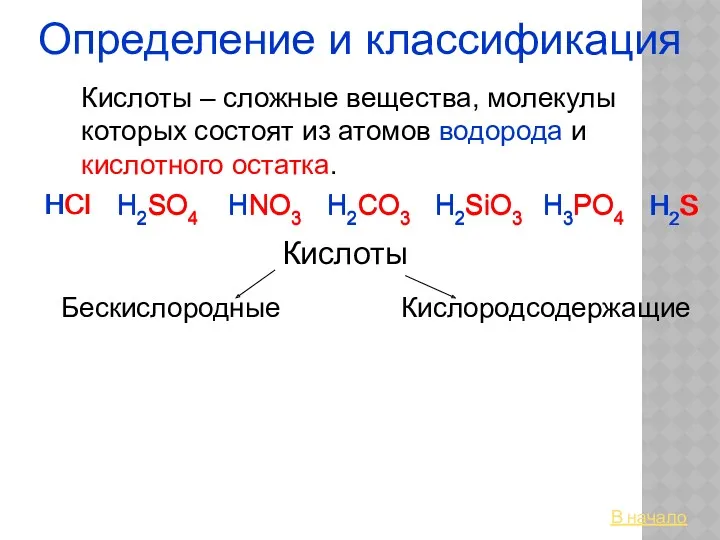 Кислоты. Определение и классификация
Кислоты. Определение и классификация Хлор. Состав. Строение
Хлор. Состав. Строение Дисперсная система
Дисперсная система Галогены. Строение атома
Галогены. Строение атома Электролиз. Области использования электролиза
Электролиз. Области использования электролиза Предмет и история геохимии
Предмет и история геохимии Простые вещества металлы
Простые вещества металлы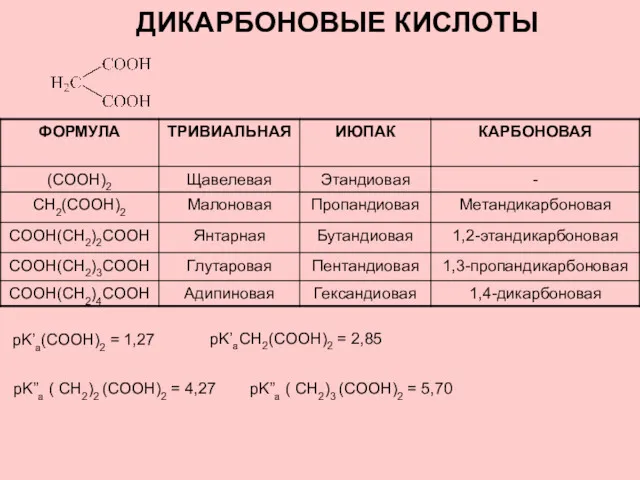 Дикарбоновые кислоты
Дикарбоновые кислоты Гидролиз органических и неорганических веществ, солей
Гидролиз органических и неорганических веществ, солей Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Аффинаж солей урана. Получение оксидов урана
Аффинаж солей урана. Получение оксидов урана Витамины. Аскорбиновая кислота
Витамины. Аскорбиновая кислота Теоретические и экспериментальные методы исследования в химии
Теоретические и экспериментальные методы исследования в химии Курс лекций: Методы диагностики и анализа микро- и наносистем
Курс лекций: Методы диагностики и анализа микро- и наносистем ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА
ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА Карбонаты. Классификация
Карбонаты. Классификация Щелочноземельные металлы
Щелочноземельные металлы Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій
Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические
Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические Выделение ферментных препаратов методами осаждения и высаливания
Выделение ферментных препаратов методами осаждения и высаливания Качественный анализ. Классификация катионов и анионов. (Лекция 2)
Качественный анализ. Классификация катионов и анионов. (Лекция 2) Качественный анализ (часть 1)
Качественный анализ (часть 1) Визитка химического элемента. Водород
Визитка химического элемента. Водород Фосфор и его соединения
Фосфор и его соединения