Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій презентация
Содержание
- 2. Аналітична хімія Одне із найважливіших завдань хімії – визначення складу речовин, розчинів, сумішей. Аналітична хімія –
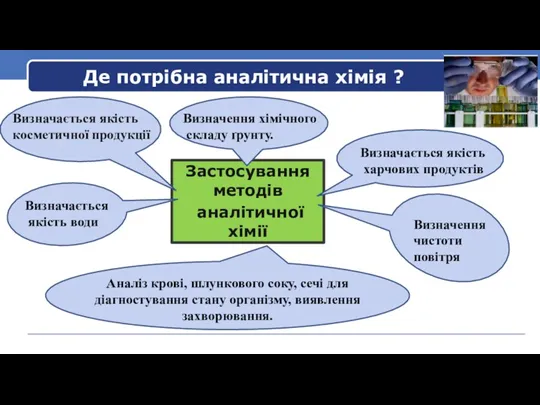
- 3. Де потрібна аналітична хімія ? Застосування методів аналітичної хімії Визначається якість харчових продуктів Визначається якість косметичної
- 4. Що таке якісні реакції? Якісні реакції – реакції, за допомогою яких можна визначити певні йони. Якісні
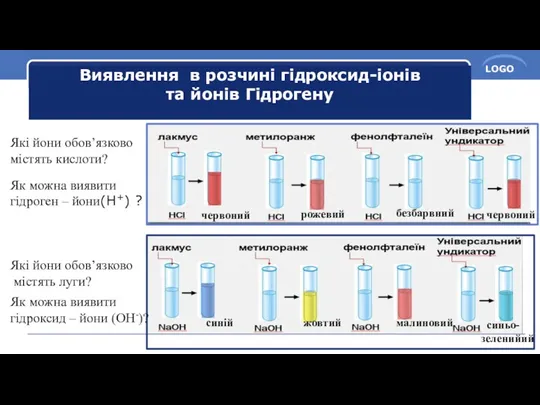
- 5. Виявлення в розчині гідроксид-іонів та йонів Гідрогену Які йони обов’язково містять кислоти? Як можна виявити гідроген
- 6. Виконуємо лабораторні досліди Лабораторні досліди №7, 8, 9. Тема: Виявлення у розчині хлорид –йонів , сульфат
- 7. Лабораторний дослід № 7. Виявлення хлорид-йонів у розчині. Налийте в одну пробірку 1 мл розчину натрій
- 8. AgNO3 + NaCl = AgCl↓ + NaNO3 Ag+ + NO3- + Na + + Cl- =
- 9. Лабораторний дослід № 8. Виявлення сульфат-йонів у розчині. Налийте в одну пробірку 1 мл розчину натрій
- 10. Рівняння реакцій BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl Ba2+ + 2Cl‾ + 2Na+ + SO42‾
- 11. Лабораторний дослід № 9. Виявлення карбонат-йонів у розчині. Налийте в пробірку 1 мл натрій карбонату (Na2CO3).
- 12. Рівняння реакцій Na2СО3 + 2НCl = 2NaCl + СО2↑ + Н2О 2Na+ + СО32─ + 2Н+
- 13. Результати дослідів занесемо в таблицю: Ag+ Ag+ + Cl- → AgCl↓ Білий сирнистий осад AgCl↓ не
- 14. Результати дослідів занесемо в таблицю:
- 16. Скачать презентацию











 Бензин. Производство бензина
Бензин. Производство бензина Types of chemical reactions
Types of chemical reactions соединения VI группы продвинутая версия
соединения VI группы продвинутая версия Азотсодержащие органические соединения
Азотсодержащие органические соединения Органическая химия. Лекция 13
Органическая химия. Лекция 13 Химическое равновесие. Смещение химического равновесия
Химическое равновесие. Смещение химического равновесия Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Изотопный обмен
Изотопный обмен Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса
Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса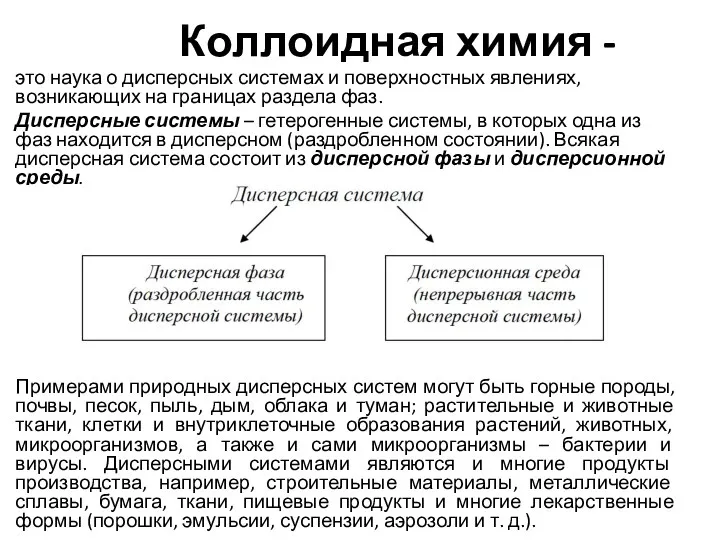 Коллоидная химия
Коллоидная химия Алкены. Этиленовые углеводороды, олефины
Алкены. Этиленовые углеводороды, олефины Nucleic acids
Nucleic acids Общая и медицинская химия
Общая и медицинская химия Создание косметических средств
Создание косметических средств Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат
Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат Алюминий и бор
Алюминий и бор Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа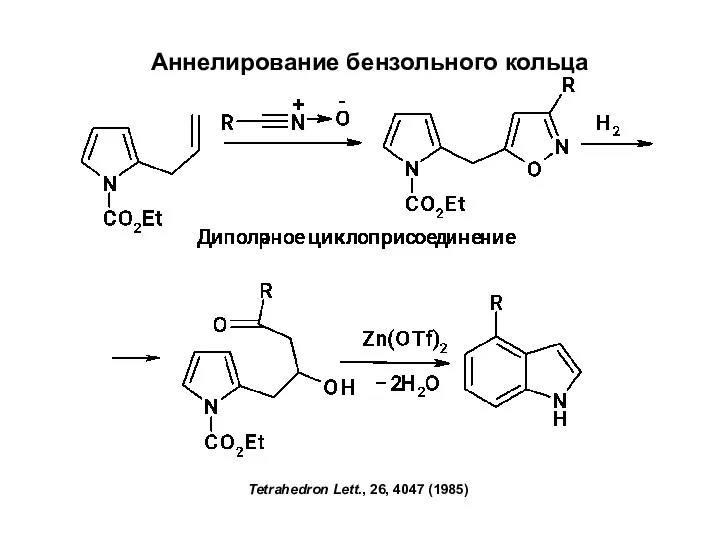 Аннелирование бензольного кольца
Аннелирование бензольного кольца Строение атома. Теории строения атома
Строение атома. Теории строения атома Анализ начальных участков изотерм адсорбции
Анализ начальных участков изотерм адсорбции Многоатомные спирты
Многоатомные спирты Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Азот и его свойства
Азот и его свойства Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Процесс электролиза
Процесс электролиза