Содержание
- 2. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей
- 3. Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы). Свойства веществ
- 4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
- 5. Формулы строения Формула строения (структурная формула) описывает порядок соединения атомов в молекуле, т.е. ее химическое строение.
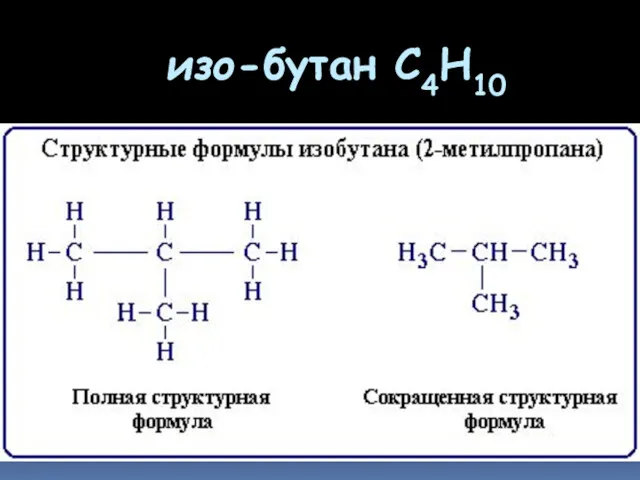
- 6. изо-бутан C4H10
- 7. Структурные изомеры соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением.
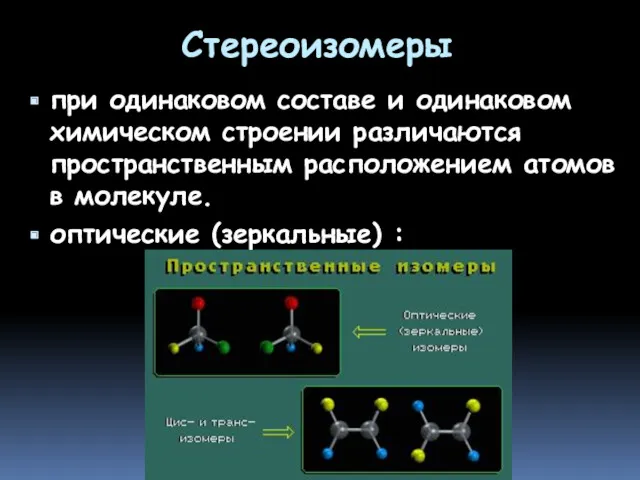
- 8. Стереоизомеры при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле. оптические (зеркальные)
- 9. Свойства органических соединений определяются: природой и электронным строением атомов; типом атомных орбиталей и характером их взаимодействия;
- 10. Атомная орбиталь (АО) область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
- 11. Типы атомных орбиталей Положение элемента в Периодической системе определяет тип орбиталей его атомов (s-, p-, d-,
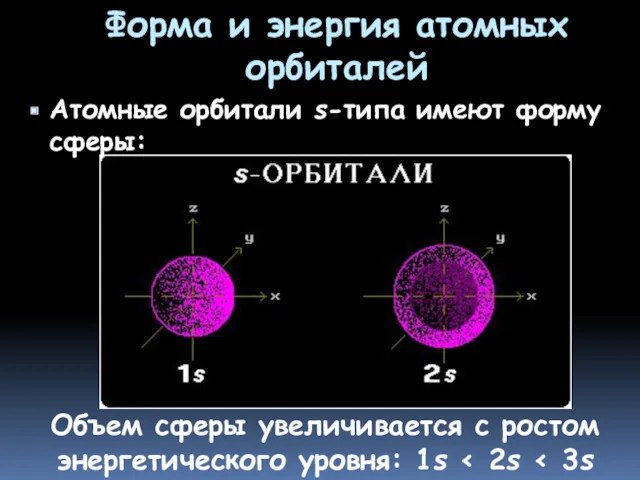
- 12. Форма и энергия атомных орбиталей Атомные орбитали s-типа имеют форму сферы: Объем сферы увеличивается с ростом
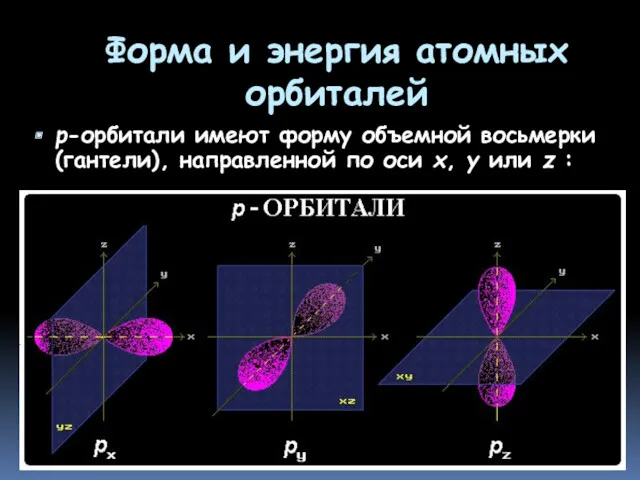
- 13. Форма и энергия атомных орбиталей р-орбитали имеют форму объемной восьмерки (гантели), направленной по оси x, y
- 14. В элементах второго периода электроны занимают пять АО на двух энергетических уровнях: первый уровень 1s; второй
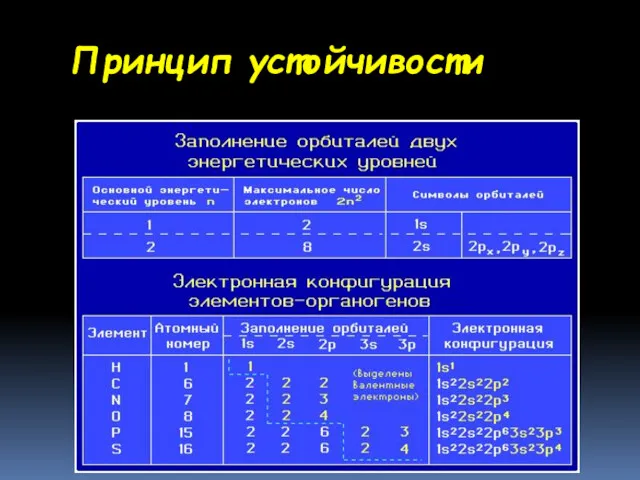
- 15. Заполнение атомных орбиталей электронами Принцип устойчивости. АО заполняются электронами в порядке повышения их энергетических уровней: 1s
- 16. Принцип устойчивости
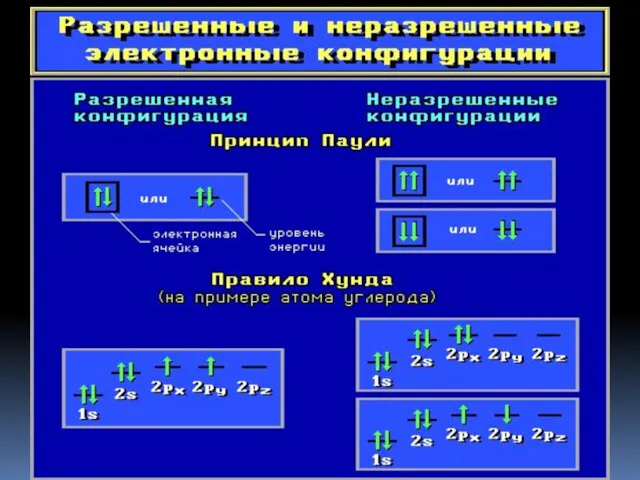
- 17. Заполнение атомных орбиталей электронами Принцип Паули. На одной АО могут находиться не более двух электронов с
- 18. Заполнение атомных орбиталей электронами Правило Хунда. На АО с одинаковой энергией, так называемых вырожденных орбиталях, электроны
- 20. Квантовые числа энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится: 1.
- 21. Квантовые числа Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра
- 22. Квантовые числа Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать
- 23. Квантовые числа Магнитное квантовое число m определяет направление орбитали в пространстве. Его значения изменяются от +l
- 24. Квантовые числа Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они
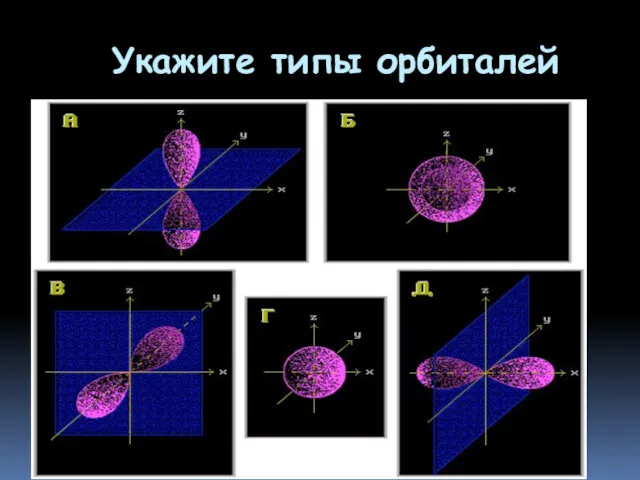
- 25. Укажите типы орбиталей
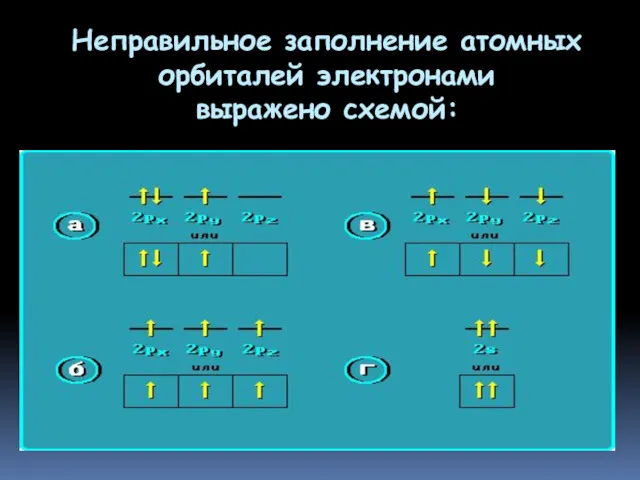
- 26. Неправильное заполнение атомных орбиталей электронами выражено схемой:
- 27. Какие из представленных на рисунке соединений являются изомерами?
- 28. Какое из положений теории А.М. Бутлерова объясняет различие в реакциях соединений одинакового состава: 2 CH3-CH2-O-H +
- 29. Контрольные вопросы
- 30. Контрольные вопросы
- 31. Контрольные вопросы
- 33. Скачать презентацию






















 Композиционные материалы для изоляции электрических машин
Композиционные материалы для изоляции электрических машин Кислоты НСL, H2 O, H2 CO3
Кислоты НСL, H2 O, H2 CO3 Физические явления – основа разделения смесей в химии (урок химии в 8 классе)
Физические явления – основа разделения смесей в химии (урок химии в 8 классе) Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Цинк и его применение
Цинк и его применение Полимеры. Каучук
Полимеры. Каучук Полисахариды. Крахмал
Полисахариды. Крахмал Третья группа, главная подгруппа. 9 класс
Третья группа, главная подгруппа. 9 класс Сложные эфиры
Сложные эфиры Закон сохранения массы веществ. Уравнения химических реакций
Закон сохранения массы веществ. Уравнения химических реакций Значення хімічних процесів у природі
Значення хімічних процесів у природі Курс лекций: Методы диагностики и анализа микро- и наносистем
Курс лекций: Методы диагностики и анализа микро- и наносистем Твердое состояние вещества. Кристаллические и аморфные тела
Твердое состояние вещества. Кристаллические и аморфные тела Гидроксиды. Основания: способы получения
Гидроксиды. Основания: способы получения Жер қыртысының заттық және химиялық құрамы
Жер қыртысының заттық және химиялық құрамы Реакции деструкции макромолекул
Реакции деструкции макромолекул Неметаллы
Неметаллы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Классификация веществ по характеру связи
Классификация веществ по характеру связи Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Chemistry of Coordination Compounds
Chemistry of Coordination Compounds Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов Субстраты и продукты биохимических реакций
Субстраты и продукты биохимических реакций Пурины. Строение пурина
Пурины. Строение пурина Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Химическая связь
Химическая связь Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Получение и применение алканов
Получение и применение алканов