Содержание
- 2. Положение неметаллов в ПС Д.И.Менделеева. Неметаллы расположены в правом верхнем углу ПС (вдоль и над диагональю
- 3. Особенности строения элементов-неметаллов. Для атомов-неметаллов характерно: Небольшой атомный радиус ( в сравнении с радиусами атомов-металлов одного
- 4. Характеристика простых веществ-неметаллов. Для неметаллов - простых веществ более характерно различие свойствах (физических и химических), чем
- 5. Физические свойства простых веществ – неметаллов. Для неметаллов (простых веществ) характерны все 3 агрегатных состояния. Твердые
- 6. Для неметаллов характерна разнообразная цветовая гамма: белый ,черный ,красный фосфор, красно-бурый бром, желтая сера, фиолетовый йод,
- 7. Аллотропия Среди неметаллов распространено явление аллотропии. Один элемент может образовывать несколько простых веществ. Причины аллотропии: Разные
- 8. Кислород О2 и озон О3 Кислород- газ, без цвета, вкуса и запаха, плохо растворим в воде,
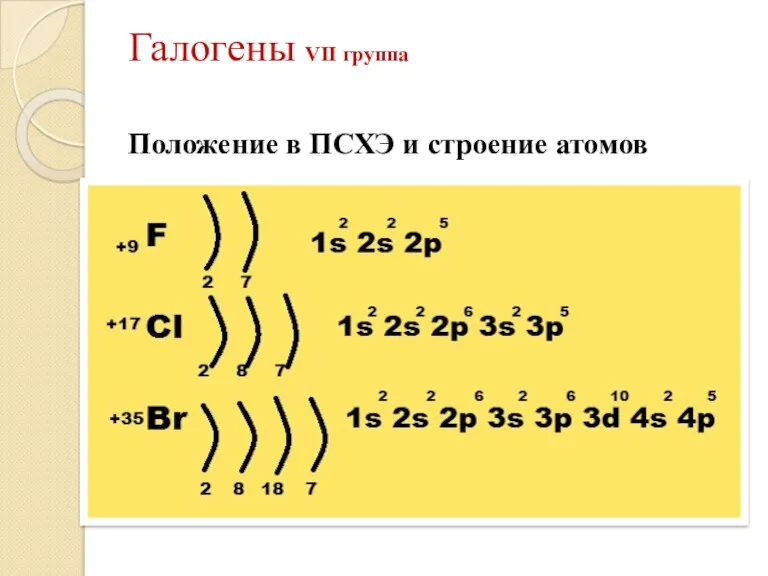
- 9. Галогены VII группа Положение в ПСХЭ и строение атомов
- 10. Общая характеристика галогенов общее на внешнем слое 7 электронов низшая степень окисления – 1 различие в
- 11. Химические свойства галогенов а) с водородом Н2 + Cl2 → НCl б) с металлами Fe +
- 12. Химические свойства соляной кислоты а) с металлами НCl + Zn → ZnCl2 + H2↑ (ПРАВИЛО!) б)
- 13. Получение хлора 1. В промышленности а) электролизом расплавов солей NaCl → Na + Cl2 б)* электролизом
- 14. Cоставьте УХР и укажите их сущность 1) Mg + Cl2 → 2) MgI2 + Cl2 →
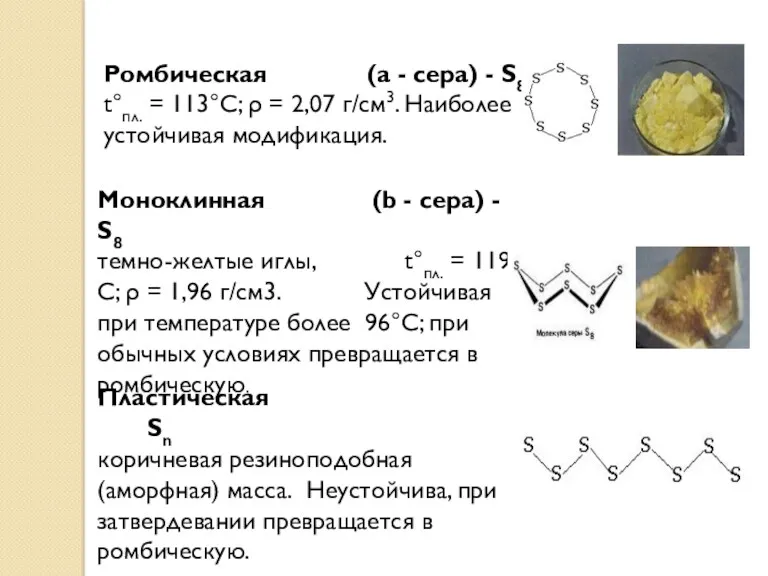
- 15. Ромбическая (a - сера) - S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
- 16. Реагирует с неметаллами (искл. азот N2 и иод I2): S + O2 = SO2 оксид серы
- 17. Реагирует с металлами (искл. золото Аu, платина Рt): Na + S → Na2S – сульфид натрия
- 18. Реагирует со сложными веществами: S + H2SO4(конц.) → SO2 + H2O S + HNO3(конц) → H2SO4
- 19. Составьте уравнения химических реакций и укажите их сущность (окислитель, восстановитель; электронный баланс)
- 20. Фосфор Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций. Обычно выделяют четыре модификации
- 21. Белый, красный, чёрный и металлический фосфор
- 22. Белый фосфор Белый фосфор представляет собой белое вещество. По внешнему виду он очень похож на очищенный
- 23. Красный фосфор Красный фосфор имеет формулу Рn и представляет собой полимерсо сложной структурой. Имеет оттенки от
- 24. Чёрный фосфор Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма
- 25. Металлический фосфор При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую
- 26. Свободный углерод В свободном виде углерод встречается в нескольких аллотропных модификациях – алмаз, графит, карбин, крайне
- 27. Алмаз Бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ, но при
- 28. Куллинан (алмаз)- 621,35 грамма, размеры: 100х65х50 мм Бриллианты: Куллинан-1, Куллинан-2, Куллинан-3 и 4
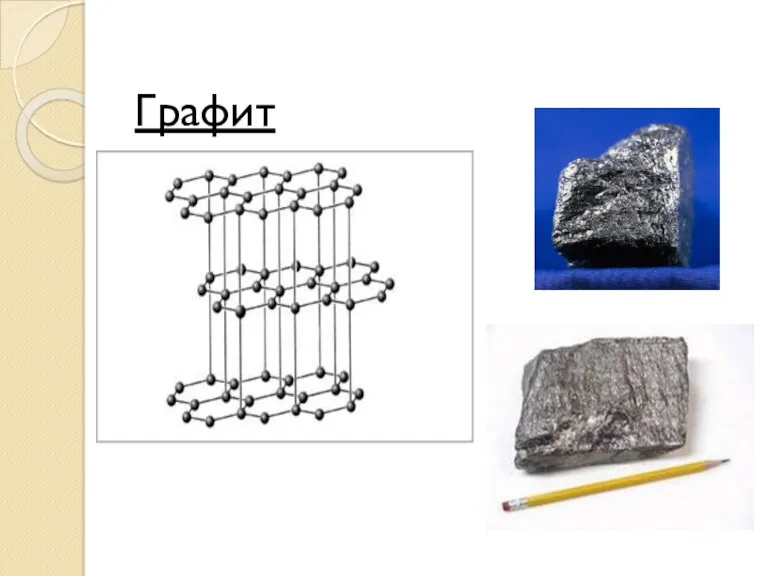
- 29. Графит Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск,
- 30. Графит
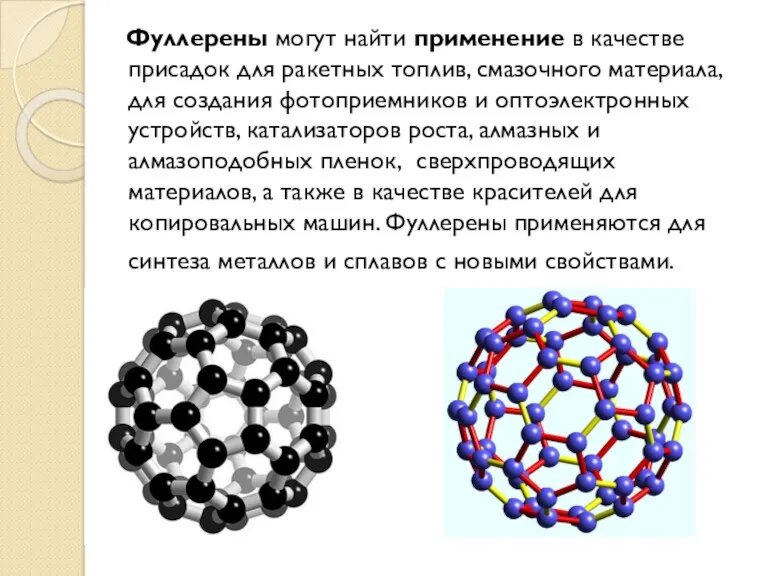
- 31. Фуллерены Фуллерены – класс химических соединений, молекулы которых состоят только из углерода, число атомов которого четно,
- 32. Фуллерены могут найти применение в качестве присадок для ракетных топлив, смазочного материала, для создания фотоприемников и
- 33. Карбин Карбин конденсируется в виде белого углеродного осадка на поверхности при облучении пирографита лазерным пучком света.
- 35. Скачать презентацию




























 Элементы VIА группы
Элементы VIА группы От кулинарии — к кулинохимии
От кулинарии — к кулинохимии Полимеры и ЕГЭ
Полимеры и ЕГЭ Глоссарий
Глоссарий Строение и свойства комплексных соединений
Строение и свойства комплексных соединений Строение и свойства циклоалканов.
Строение и свойства циклоалканов. Азотсодержащие органические соединения
Азотсодержащие органические соединения Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Химические свойства алкенов
Химические свойства алкенов Реакции при нагревании
Реакции при нагревании Азот и его соединения. Повторение
Азот и его соединения. Повторение Растворы. Электролитическая диссоциация
Растворы. Электролитическая диссоциация Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Роль химии в жизни человека
Роль химии в жизни человека Ароматические углеводороды, строение, изомерия, номенклатура
Ароматические углеводороды, строение, изомерия, номенклатура Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Классификация конструкционных материалов. Особенности атомно-кристаллического строения металлов. Лекции №1
Классификация конструкционных материалов. Особенности атомно-кристаллического строения металлов. Лекции №1 Металлы и сплавы в искусстве
Металлы и сплавы в искусстве Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9)
Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9) Химия в быту
Химия в быту Диссоциация кислот, оснований, солей
Диссоциация кислот, оснований, солей Organic compounds: nomenclature
Organic compounds: nomenclature Массовая доля вещества в растворе
Массовая доля вещества в растворе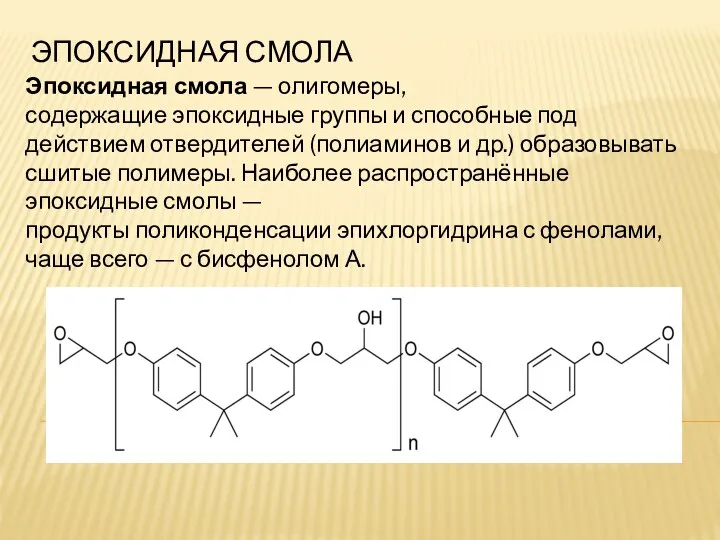 Эпоксидная смола
Эпоксидная смола Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Алены. Строение, изомерия, номенклатура
Алены. Строение, изомерия, номенклатура Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов Органические производные пятивалентного фосфора. Способы получения
Органические производные пятивалентного фосфора. Способы получения