Слайд 2
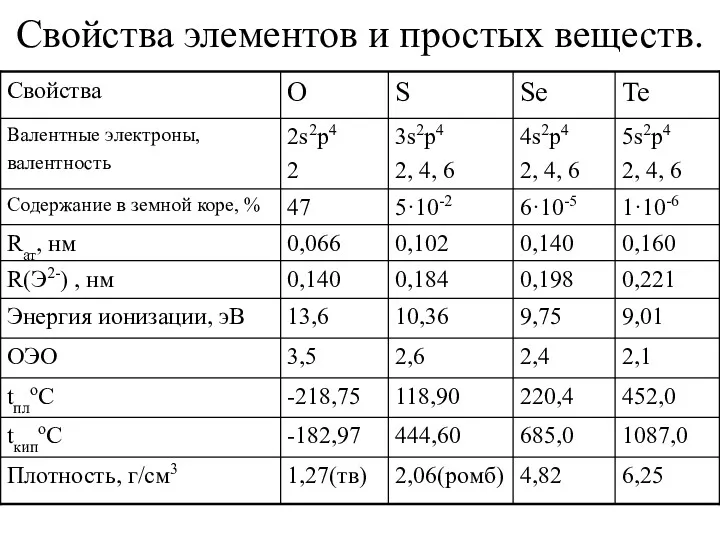
Свойства элементов и простых веществ.
Слайд 3

Кислород
В природе - входит в состав: Н2О, кварца, карбонатов, силикатов, алюмосиликатов,
живых организмов. Составляет 21% воздуха по объему.
На высоте 25 км образует озоновый экран (О3).
Получение. В промышленности:
1)ректификация жидкого воздуха, 2)электролиз Н2О.
2)В лаборатории - термическое разложение KMnO4 при 250оС, и KClO3 при 400оС:
2KMnO4=K2MnO4+MnO2+O2
2KClO3=2KCl+3O2
Слайд 4

Свойства кислорода
Физические: бесцветных газ, не имеющий запаха, тяжелее воздуха, мало растворим
в воде (в 100 об. Н2О – 5 об. О2 при 0оС).
Химические. Образует соединения со всеми элементами кроме He, Ne, Ar.
Непосредственно не взаимодействует только с галогенами, Au, Pt.
Белый фосфор (Р4), Ba, Rb, Cs + O2 → самовоспламенение.
С др. в-вами взаимодействует при нагревании, облучении или в присутствии катализатора.
Слайд 5
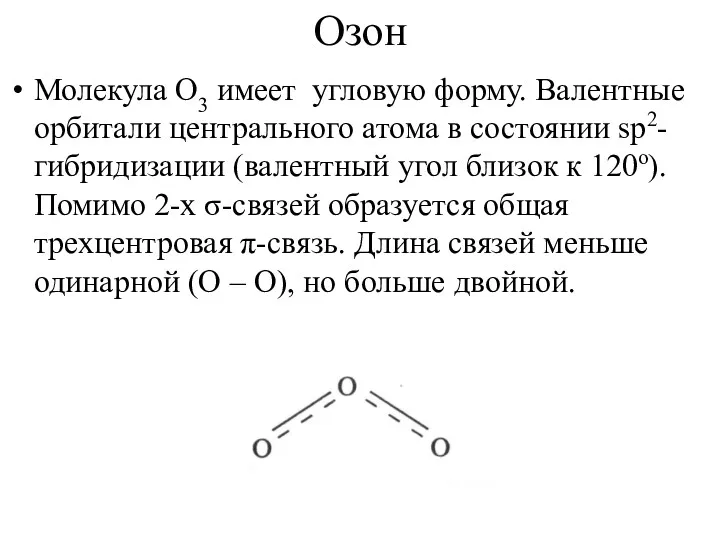
Озон
Молекула О3 имеет угловую форму. Валентные орбитали центрального атома в состоянии
sp2-гибридизации (валентный угол близок к 120о). Помимо 2-х σ-связей образуется общая трехцентровая π-связь. Длина связей меньше одинарной (О – О), но больше двойной.
Слайд 6

Свойства озона
Бесцветный газ с резким запахом, растворяется в воде ( в
100 об Н2O - 49 об. О3), в жидком состоянии имеет синюю окраску, tкип=-111,9оС (выше чем у О2), ядовит.
О3 – сильный окислитель. Окисляет металлы (кроме Au, Pt), неметаллы, сложные вещества.
Качественная реакция:
2KI+H2O+O3=I2+2KOH+O2
Получение – действием тихого электрического разряда на О2 в озонаторе.
Слайд 7

Применение кислорода и озона
О2 – интенсификация процессов в производстве H2SO4, HNO3,
чугуна, стали.
Получение высоких to в ацетиленовых и водородных горелках.
В медицине - при затрудненном дыхании.
О3 – обеззараживание воды и дезинфекция воздуха.
Окислитель в органической химии, реактивной технике.
Слайд 8

Сера
Нахождение в природе: FeS2 – пирит, CuFeS2- медный колчедан, PbS –
свинцовый блеск, ZnS – цинковая обманка, CaSO4·2H2O –гипс, Na2SO4·10H2O – мирабилит.
Получение – выплавление из горных пород самородной серы;
разложение полисульфидов: FeS2=tFeS+S;
из газов, образующихся при коксовании и газификации угля:
2H2S+3O2=2H2O+2SO2, 2H2S+SO2=2H2O+3S↓.
Слайд 9

Аллотропия серы
Sромбическая - α-сера – хрупкие, желтые кристаллы без запаха, нерастворимые
в воде, хорошо растворимы в сероуглероде (циклические молекулы S8).
Sмоноклинная – β-сера образуется при t>95,4оС, светло-желтые пластинчатые кристаллы (S8).
Пластическая – темная резиноподобная масса, образуется, при быстром охлаждении водой расплавленной и выдержанной при 250оС S.
Слайд 10

Химические свойства серы
При to взаимодействует с простыми веществами кроме: инертных газов,
N2, Se, Te, I2 , Au.
Восстанавливается:
S+Zn=ZnS2-
S+H2=H2S2-
Окисляется:
S+O2=SO2
S+4HNO3(к)=H2SO3+4NO2↑+H2O
2S+3O2+4NaOH(расплав) =2Na2SO4+2H2O
Диспропорционирует:
3S+6NaOH(р-р)=t 2Na2S+Na2SO3+3H2O.
Слайд 11

Соединения серы в С.О. 2-
H2S – сероводород – бесцветный ядовитый газ
с запахом тухлых яиц, растворим (1v H2O:3v H2S). Форма молекулы – равнобедренный треугольник.
Сильный восстановитель - горит на воздухе, окисляется галогенами:
2H2S+3O2=2SO2+2H2O,
2H2S+O2=2H2O+2S;
H2S+Br2=2HBr+S
В воде - сероводородная кислота – слабая :
H2S↔H++HS- (K1=8,7·10-8)
HS-↔H++S2- (K2=1,3·10-13)
Сульфиды – соли сероводородной кислоты. Растворимые соли щелочных Ме подвергаются гидролизу:
S2-+HOH=OH-+ HS-,
K2S+HOH=KOH+KHS
гидросудьфид калия (кислая соль)
Слайд 12

Химические свойства сульфидов
Восстановительные свойства:
2Na2S+3O2=2Na2SO3 (сульфит)
Na2S+2O2=t Na2SO4 (сульфат).
Нерастворимые сульфиды получают реакциями обмена:
CuSO4+H2S=H2SO4+CuS↓
(ПР=3,2·10-38)
CuS, HgS не растворяются в H2SO4..
Другие сульфиды:
FeS+H2SO4=H2S↑+FeSO4 (ПР(FeS)= 5·10-18 )
FeS нельзя получить действием H2S на р-р соли, но можно - реакцией между солями:
Na2S+FeSO4=FeS↓+Na2SO4
S2-+Fe2+=FeS↓
Слайд 13

Соединения серы в С.О. +4
SO2 – оксид серы(IV) –бесцветный газ с
резким запахом горящей серы, растворим в воде (1v H2O:40v SO2 при 20оС).
Сернистая кислота – H2SO3:
H2O+SO2<=>H2SO3 <=> H++HSO3- <=> 2H++SO32-
Непрочная, слабая (K1=1,3·10-2; K2=6,8·10-8), двухосновная кислота образует сульфиты(Na2SO3) и гидросульфиты (NaHSO3).
Восстановительные св-ва: 2H2SO3+O2=2H2SO4
Окислительные св-ва: H2SO3+2H2S=3S+3H2O
Сульфиты наиболее активных металлов диспропорционируют при прокаливании: 4Na2SO3=tNa2S+3Na2SO4.
Гидролизуются по аниону: Na2SO3+HOH=NaHSO3+NaOH.
Слайд 14

Соединения серы в С.О. +6
SO3 – оксид серы(VI) – бесцветная, легко
подвижная жидкость.
Форма молекулы – плоский правильный Δ, в центре - S (sp2-гибридизация, валентный ∟OSO=120о).
Получают каталитическим окислением SO2:
2SO2+O2= 2SO3
Сильный окислитель: 2SO3+C=CO2+SO2
Образует H2SO4 :
SO3+H2O=H2SO4
Слайд 15

Серная кислота и её соли
H2SO4 - бесцветная, маслянистая, гигроскопичная жидкость.
Сильный
окислитель ( в р-циях с Ме, неМе и сложными в-вами):
8HI+H2SO4=4I2+H2S+4H2O
C+2H2SO4=CO2+2SO2+2H2O
Сильная двухосновная кислота:
H2SO4→H++HSO4-,
HSO4-↔SO42-+H+ (K2=10-2).
Соли – сульфаты: K2SO4, MgSO4, CaSO4, CuSO4;
гидросульфаты: NaHSO4, KHSO4.
Нерастворимые: BaSO4, SrSO4, PbSO4.
Качественная реакция на ионы SO42-:
SO42-+Ba2+=BaSO4↓
Слайд 16

Тиосерная кислота и ее соли
Тиосерная кислота – H2S2O3 – неустойчива, распадается
при комнатной температуре.
С.О. атомов S +4 и 0:
H2S2O3=H2O+SO2↑+S↓
Na2S2O3·5H2O – тиосульфат натрия - восстановитель:
Na2S2O3+4Cl2+5H2O=2H2SO4+2NaCl+6HCl
Получение - кипячение р-ра Na2SO3 с S:
S+Na2SO3=Na2S2O3















 Циклоалканы. Предельные углеводороды
Циклоалканы. Предельные углеводороды Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Дисперсные системы
Дисперсные системы Мінерали та гірські породи
Мінерали та гірські породи Электролитическая диссоциация химических элементов
Электролитическая диссоциация химических элементов Химические волокна. Полиэфирные волокна. Лавсан
Химические волокна. Полиэфирные волокна. Лавсан Химия в повседневной жизни человека
Химия в повседневной жизни человека Темір. Жай заттармен
Темір. Жай заттармен Метаморфогенные месторождения
Метаморфогенные месторождения Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль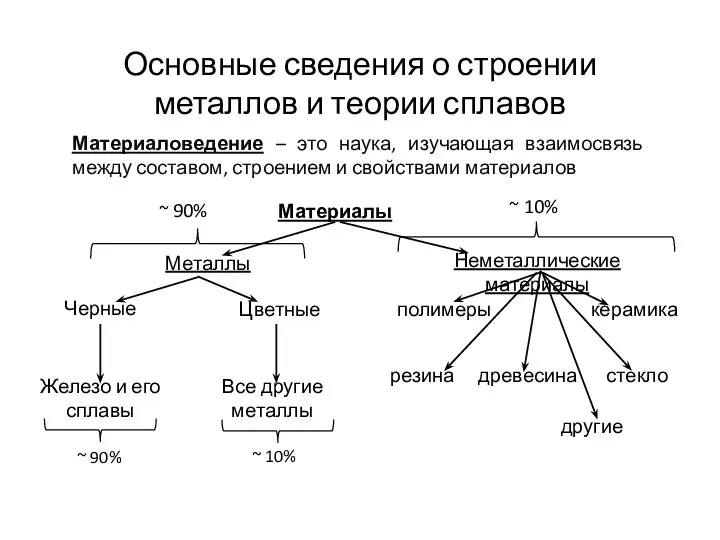 Основные сведения о строении металлов и теории сплавов
Основные сведения о строении металлов и теории сплавов Определение химического элемента на основании расчетов по химическим реакциям
Определение химического элемента на основании расчетов по химическим реакциям Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню
Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Валентность и степень окисления элементов
Валентность и степень окисления элементов Амины. Классификация аминов. Характеристика метиламина и анилина
Амины. Классификация аминов. Характеристика метиламина и анилина Кристаллические решетки
Кристаллические решетки Физические явления в химии. Чистые вещества и смеси
Физические явления в химии. Чистые вещества и смеси Аммиак
Аммиак Исследовательский проект определение качества питьевой воды в домашних условиях
Исследовательский проект определение качества питьевой воды в домашних условиях Смог и его виды
Смог и его виды Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Оксиды. Формулы оксидов ( 8 класс)
Оксиды. Формулы оксидов ( 8 класс) Урок 25
Урок 25 Драгоценные камни
Драгоценные камни Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Основания. 8 класс
Основания. 8 класс Презентация лекция 10 Реактора МБ
Презентация лекция 10 Реактора МБ