Содержание
- 2. Электролитическая диссоциация химических элементов Демонстрационный эксперимент
- 3. Электролитическая диссоциация химических элементов
- 4. Электролитическая диссоциация химических элементов Процесс распада электролита на ионы называется электролитической диссоциацией 1877 год
- 5. Электролитическая диссоциация химических элементов Механизм диссоциации веществ с ионной связью
- 6. Электролитическая диссоциация химических элементов Механизм диссоциации веществ с ковалентной полярной связью
- 7. Электролитическая диссоциация химических элементов В растворе не все молекулы электролита распадаются на ионы, поэтому растворы характеризуются
- 8. Электролитическая диссоциация химических элементов
- 10. Электролитическая диссоциация химических элементов Сильные электролиты: 1) все растворимые соли; 2) сильные кислоты (H2SO4, HCl, HNO3);
- 11. Электролитическая диссоциация химических элементов Слабые электролиты: слабые кислоты (H2S, H2CO3, HNO2); водный раствор аммиака NH3 H2O;
- 12. Электролитическая диссоциация химических элементов Основные положения теории: Электролиты при растворении в воде распадаются (диссоциируют) на ионы
- 13. Электролитическая диссоциация химических элементов Основные положения теории: 2. Причиной диссоциации электролита в водных растворах является его
- 14. Электролитическая диссоциация химических элементов Основные положения теории: 3. При действии электрического тока ионы приобретают направленное движение:
- 15. Электролитическая диссоциация химических элементов Основные положения теории: 4. Диссоциация – обратимый процесс: параллельно с распадом молекул
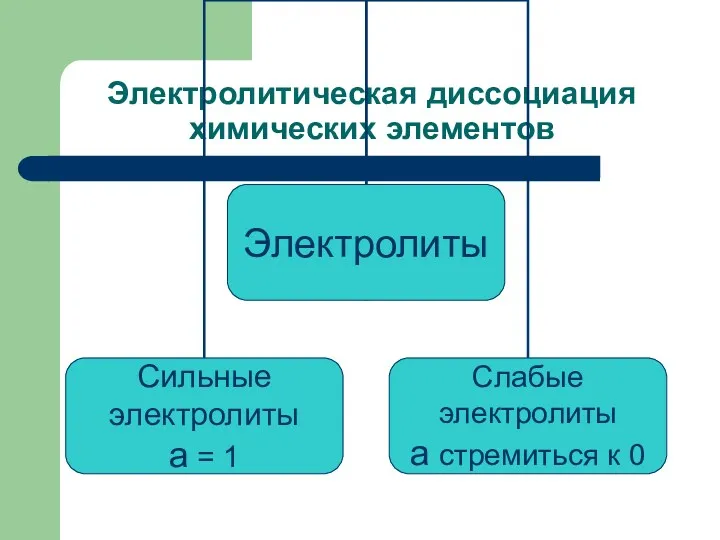
- 16. 5. Основные положения теории: Не все электролиты диссоциируют на ионы в равной мере. (сильные и слабые)
- 17. Электролитическая диссоциация химических элементов Кислоты – это электролиты, которые диссоциируют на ионы водорода и кислотного остатка.
- 18. Электролитическая диссоциация химических элементов Соли – это электролиты, которые диссоциируют на ионы металла и кислотного остатка
- 19. Электролитическая диссоциация химических элементов Основания - это электрлиты, которые диссоциируют на ионы металла и гидроксид-ионы +
- 20. Электролитическая диссоциация химических элементов Слабые многоосновные кислоты и основания, содержащие более одной гидроксидных групп диссоциируют многоступенчато:
- 22. Скачать презентацию


















 Химические источники тока. Электролиз
Химические источники тока. Электролиз Вуглеводи
Вуглеводи Термодинамика биологических процессов
Термодинамика биологических процессов Спирти
Спирти Классификация минералов
Классификация минералов Полипропилен
Полипропилен Tungsten. (Вольфрам)
Tungsten. (Вольфрам) Дикарбоновые кислоты
Дикарбоновые кислоты Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Углерод, аллотропные модификации
Углерод, аллотропные модификации Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Фотохимический смог и химизм его образования
Фотохимический смог и химизм его образования Философы химии Кант и Гегель
Философы химии Кант и Гегель Строение атома. Лекция № 2
Строение атома. Лекция № 2 Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Спирты (алканолы)
Спирты (алканолы) Основные синтетические полимеры
Основные синтетические полимеры Изохинолин туындыларының дәрілік заттарын талдау
Изохинолин туындыларының дәрілік заттарын талдау Реакции ионного обмена
Реакции ионного обмена Химическая посуда и ее назначения (5)
Химическая посуда и ее назначения (5) Магматические горные породы
Магматические горные породы Соли
Соли Щелочные металлы
Щелочные металлы Химическая связь и ее типы. Основные классы неорганических соединений
Химическая связь и ее типы. Основные классы неорганических соединений Научно – исследовательская работа Газированная вода - вред или польза?
Научно – исследовательская работа Газированная вода - вред или польза? Серная кислота и её свойства
Серная кислота и её свойства Качественные реакции на органические вещества
Качественные реакции на органические вещества Валентність хімічних елементів
Валентність хімічних елементів