Содержание
- 2. Тема урока: «Серная кислота и её свойства» (1 урок) Я растворю любой металл. Меня алхимик получал
- 3. ЦЕЛЬ УРОКА: Изучить свойства разбавленной серной кислоты и выявить общие свойства , которые характерны для кислот,
- 4. «Лучший путь к истине – это изучать вещи, как они есть, а не верить, что они
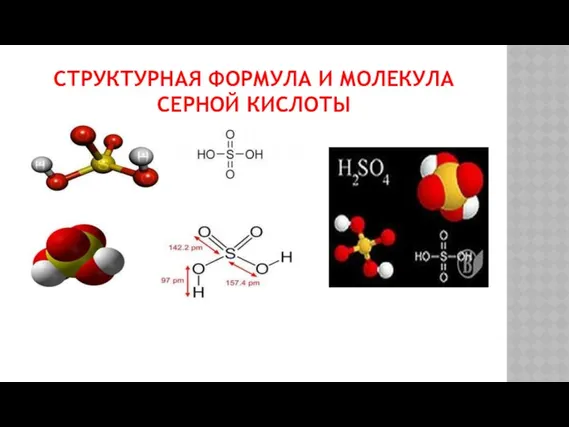
- 5. СТРУКТУРНАЯ ФОРМУЛА И МОЛЕКУЛА СЕРНОЙ КИСЛОТЫ
- 6. ПРОИЗВОДСТВО МИНЕРАЛЬНЫХ УДОБРЕНИЙ Простой Преципитат Двойной суперфосфат суперфосфат Сульфат аммония
- 7. ЭЛЕКТРОЛИТ В СВИНЦОВЫХ АККУМУЛЯТОРАХ
- 8. ПРОИЗВОДСТВО Синтетических Красителей Пластмасс моющих средств Лекарственных препаратов
- 9. Обогащение руд Очистка нефтепродуктов Керосин Парафин Смазочные масла Осушение газов
- 10. В ОТРАСЛЯХ ПРОМЫШЛЕННОСТИ Металло- Текстильная обрабатывающая Кожевенная
- 11. В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ Пищевая добавка Е513 регулятор кислотности
- 12. Органический синтез Сульфо- Этиловый Уксусная кислоты спирт кислота Водоотнимающее средство Нитробензол Нитроглицерин Пироксилин
- 13. ПРИМЕНЕНИЕ СОЛЕЙ Медный купорос Железный купорос Горькая соль
- 15. ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ ОБРАЩЕНИЯ С H2SO4 1. Обращаться осторожно. 2. Работать в резиновых перчатках и защитных
- 16. ФИЗИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ Безводная серная кислота - это бесцветная маслянистая жидкость без запаха, смешивается с
- 17. H2SO4 ДИССОЦИАЦИЯ гидросульфаты HSO4- сульфаты H+ + HSO4- H+ + SO42-
- 18. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ Al + H2SO4 → 2Al3+ + 6 H+ → 2Al3+ + 3H2↑ Ме
- 19. ZnO + H2SO4 → ZnO + 2H+ → Zn2+ + H2O ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ МеxOy
- 20. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ NaOH + H2SO4 → Ме(OH)n + Hx(ko)→ Mex(ko)y + H2O Na2SO4 + 2H2O
- 21. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ Zn(OH)2 + H2SO4 → Zn(OH)2 +2H+ +SO42-→Zn2+ +SO42-+ 2H2O Ме(OH)n + Hx(ko)→ Mex(ko)y
- 22. K2SO4 + H2CO3 CO2↑ H2O Взаимодействие с солями H2SO3 2H+ + CO32- = CO2↑+ H2O K2CO3
- 23. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СУЛЬФАТ-ИОН Сера образует ряд кислот. Соли серной кислоты H2SO4 называют сульфатами. Качественная реакция
- 24. ХИМИЧЕСКИЕ СВОЙСТВА КОНЦЕНТРИРОВАННОЙ КИСЛОТЫ: 1.Сильный окислитель. Обугливает органические вещества . С12Н22О11------>12С+11Н2О 2. С водой образует гидраты:
- 25. ВЗАИМОДЕЙСТВИЕ КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ С МЕТАЛЛАМИ
- 26. ВЗАИМОДЕЙСТВИЕ САХАРА С КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТОЙ
- 27. РАЗЛИВ СЕРНОЙ КИСЛОТЫ
- 28. СИНКВЕЙН Составить по схеме: название темы – одно существительное описание темы – два прилагательных описание действия-3
- 29. НАПРИМЕР: Кислород Безликий и сверкающий Зажигает, окисляет, завораживает Самый распространенный элемент на Земле Основа жизни!
- 30. ДОМАШНЕЕ ЗАДАНИЕ: 1.Подготовить мини-проект по теме: «Серная кислота и проблемы экологии» . 2.Записать молекулярные, полные и
- 31. ПОДУМАЕМ И ОТВЕТИМ. (ДА ИЛИ НЕТ) 1. Сера располагается в 6 главной группе ПС . 2.На
- 32. ИТОГОВАЯ ОЦЕНКА
- 33. ПРОВЕРИМ РЕЗУЛЬТАТЫ ТЕСТА:
- 34. ПРОВЕРИМ СВОИ ЗНАНИЯ! Выберите, с какими из перечисленных веществ реагирует разбавленная серная кислота: цинк, оксид меди(II),
- 36. Скачать презентацию






























 Общая характеристика неметаллов
Общая характеристика неметаллов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Аморфные сплавы
Аморфные сплавы Электролиз. Классификация
Электролиз. Классификация Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы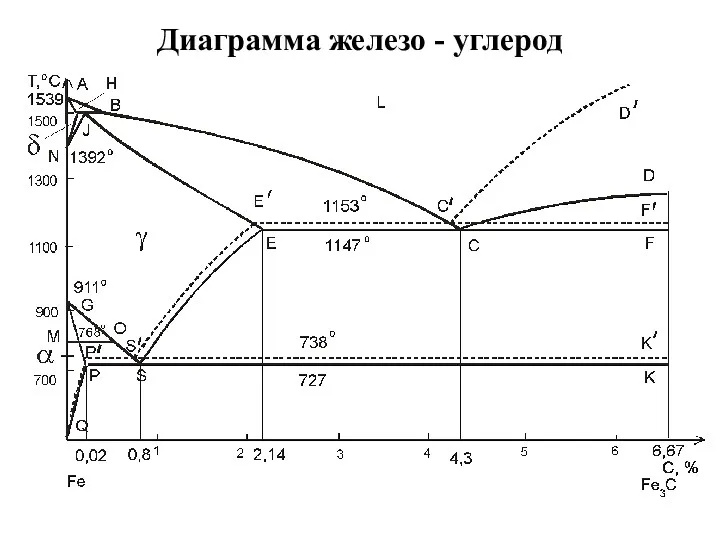 Диаграмма железо - углерод
Диаграмма железо - углерод Хром. Химиялық қасиеттері
Хром. Химиялық қасиеттері Анализ 3% раствора водорода пероксида
Анализ 3% раствора водорода пероксида Alkynes
Alkynes Металлическая связь
Металлическая связь Аминокислоты алифатического ряда и их производные
Аминокислоты алифатического ряда и их производные Комплексные соединения
Комплексные соединения Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів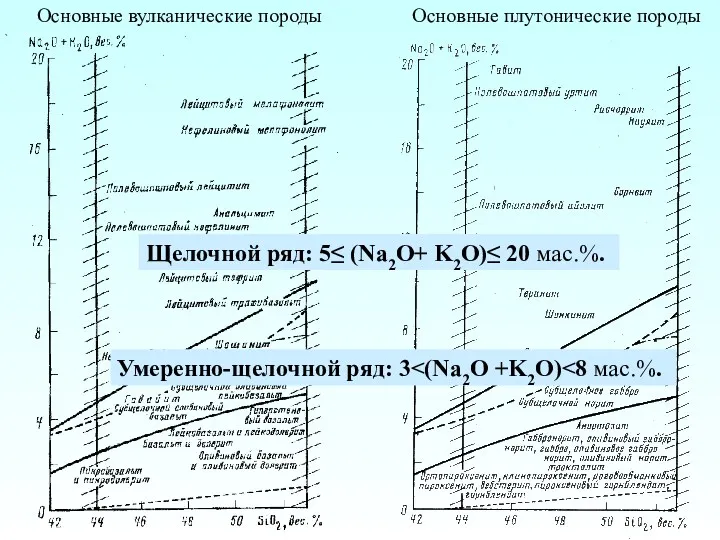 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Утворення асимілятів та їхнє перетворення
Утворення асимілятів та їхнє перетворення Технология промышленных газов
Технология промышленных газов Кислотно-основное титрование
Кислотно-основное титрование Химические свойства алкенов
Химические свойства алкенов Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Элементы пятой-А группы. Азот и фосфор
Элементы пятой-А группы. Азот и фосфор Анілін. Фізичні властивості
Анілін. Фізичні властивості Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар
Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар Анализ анионов. Анализ смеси солей
Анализ анионов. Анализ смеси солей Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества 20230419_oksidy
20230419_oksidy