Содержание
- 2. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНИОНЫ
- 4. Реакции SO4 2- 1. Реакция с хлоридом бария. Na2SO4 + BaCl2 = BaSO4 ↓ + 2
- 5. Реакции СО3 2- 1. Реакция с кислотами. CaCO3 + 2 HCl = H2CO3 + CaCl2 H2CO3
- 6. Реакции Cl- 1. Реакция с нитратом серебра. AgNO3 + HCl = AgCl ↓ + HNO3 К
- 7. 2 группа анионов
- 12. Реакции NO3 - 1. Реакция с сульфатом железа(II). 2 HNO3 + 6FeSO4 + 3H2SO4 = 3
- 13. S2- – ион обнаруживают при подкислении раствора разбавленной НCI: S2- + 2HCI → Н2S ↑ +
- 14. NO2– – ион открывают по реакции с реактивом Грисса-Илошвая (смесь сульфаниловой кислоты HSO3C6H4NН2 с 1 –
- 15. 1. Реакция с магнезиальной смесью (MgCl2 + NH3 + NH4Cl): PO43- + MgCI2 + NH3 =
- 16. Реакции фосфат ионов PO43- 2. Реакция с молибдатом аммония (NH4) 2MoО4: PO43- + 3NH4+ + 12MoO42-
- 17. АНАЛИЗ СМЕСИ СОЛЕЙ
- 18. Есть задача. Определить качественный состав смеси солей. ?
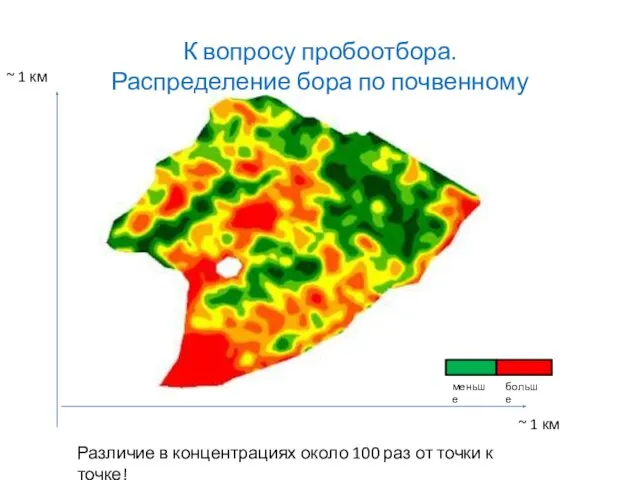
- 19. Проблемы. Поиск решения. Правильная постановка задачи\цели. А) Отбор пробы. Б ) Что определяем? В) Уровень концентраций.
- 20. К вопросу пробоотбора. Распределение бора по почвенному участку меньше больше
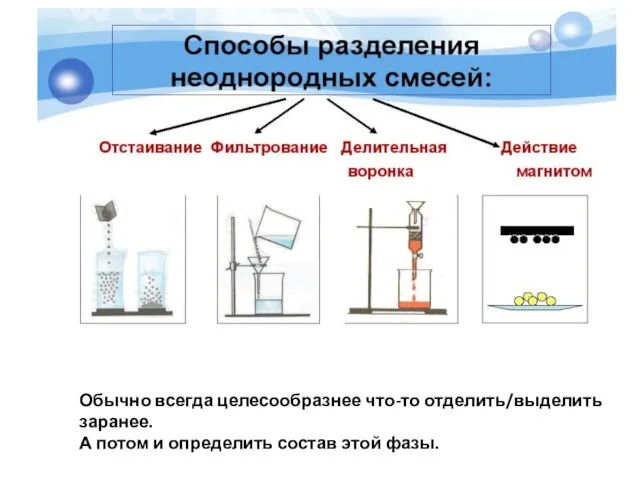
- 22. Обычно всегда целесообразнее что-то отделить/выделить заранее. А потом и определить состав этой фазы.
- 24. Задачи первичной пробоподготовки 1.Высушивание пробы (удаление воды 2.Гомогенизация (достижение однородности пробы) 3.Вскрытие (разложение пробы) и перевод
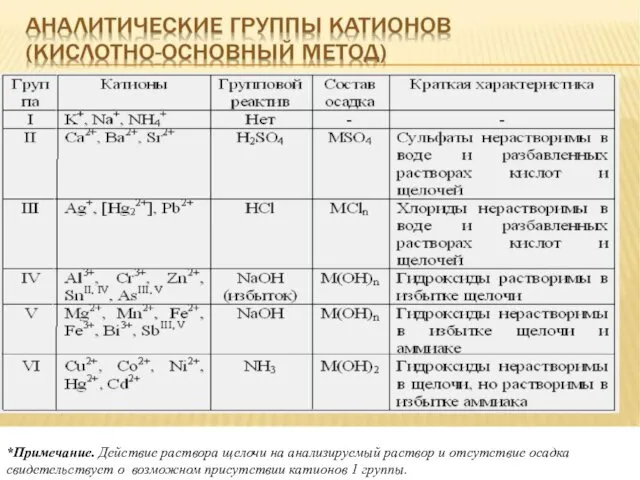
- 26. *Примечание. Действие раствора щелочи на анализируемый раствор и отсутствие осадка свидетельствует о возможном присутствии катионов 1
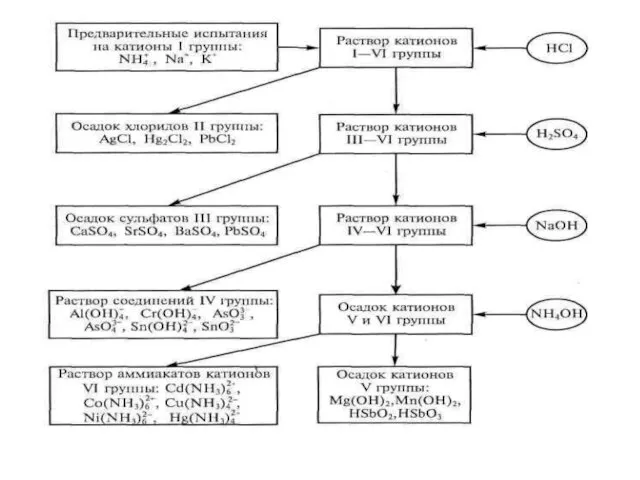
- 27. По практическому руководству «ОСНОВЫ АНАЛИТИЧЕСКОЙ ХИМИИ»
- 31. Анализ смеси катионов первой аналитической группы: NH4+, Na+, K+, Li+. Возможно (и предпочтительнее) использовать дробное обнаружение.
- 32. Здесь в основном используют дробный анализ 1. Открытие катионов бария (II): Ва3+ + К2Сr2O7 (в прис.
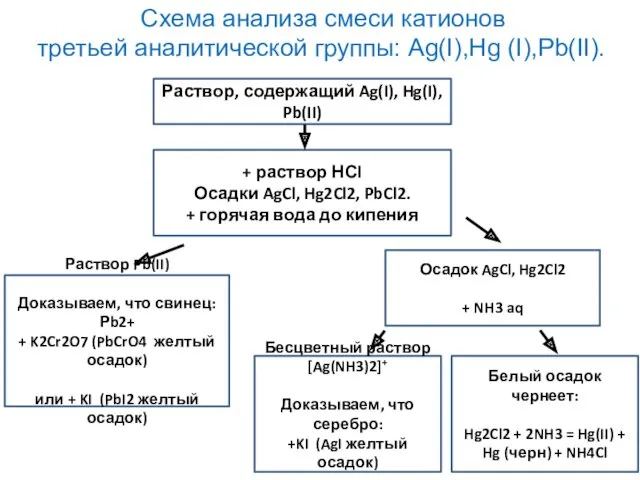
- 33. Анализ смеси катионов третьей аналитической группы: Ag(I),Hg (I),Pb(II). Открыть ионы дробно в смеси невозможно, т.к. нет
- 34. Схема анализа смеси катионов третьей аналитической группы: Ag(I),Hg (I),Pb(II). Раствор, содержащий Ag(I), Hg(I), Pb(II) + раствор
- 35. Анализ смеси катионов четвертой аналитической группы: Zn(II), Al (III), Cr(III), As(V). Sn(II), Sn(IV), Mo(VI), V(V). Схему
- 36. Анализ смеси катионов шестой аналитической группы: Cu(II), Cd(II), Co(II), Ni(II) Некоторые выводы можно сделать по окраске
- 37. Анализ раствора с осадком Если анализируемый объект представляет собой раствор с осадком, то вначале эту смесь
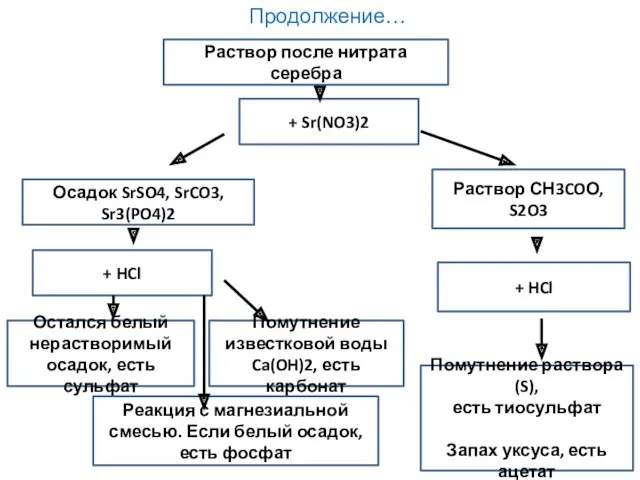
- 38. Схема анализа смеси анионов: SO42-, PO43-, CO32-, NO3-, NO2-, CH3COO-, Cl-, Br-, I-, S2O32-, S2- К
- 39. Продолжение… Осадок SrSO4, SrCO3, Sr3(PO4)2 + Sr(NO3)2 Раствор после нитрата серебра Раствор СН3COО, S2O3 Остался белый
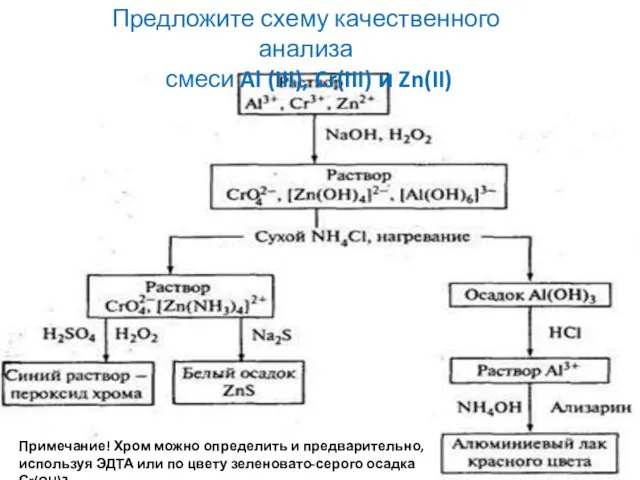
- 40. Предложите схему качественного анализа смеси Al (III), Cr(III) и Zn(II) Примечание! Хром можно определить и предварительно,
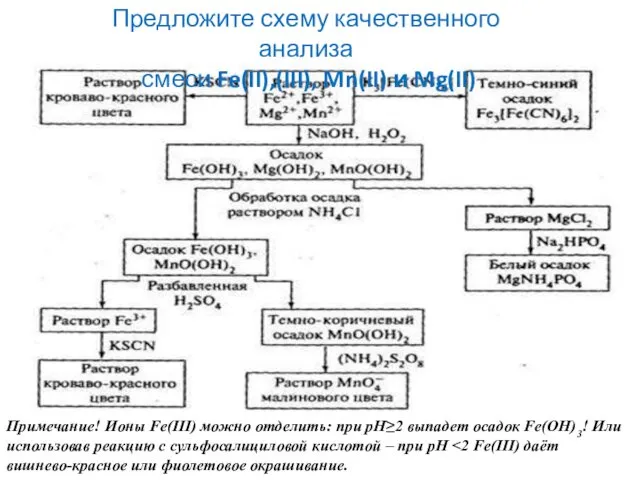
- 41. Предложите схему качественного анализа смеси Fe(II),(III), Mn(II) и Mg(II) Примечание! Ионы Fe(III) можно отделить: при рН≥2
- 43. Скачать презентацию
































 Protein Chemistry
Protein Chemistry Озон. Применение
Озон. Применение Кремний и его соединения
Кремний и его соединения Полисахаридтер – жоғары молекулалық көмірсулар
Полисахаридтер – жоғары молекулалық көмірсулар Химические свойства легкоплавких металлов
Химические свойства легкоплавких металлов Неоднородные смеси
Неоднородные смеси Массовая и объемная доли компонентов смеси (раствора)
Массовая и объемная доли компонентов смеси (раствора) Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования i9tjjvxuvf7fj7k4drnlmj56tgok
i9tjjvxuvf7fj7k4drnlmj56tgok Физические и химические свойства аренов
Физические и химические свойства аренов Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Химический элемент таблицы Менделеева - Азот
Химический элемент таблицы Менделеева - Азот Классификация карбоновых кислот. (Лекция 12)
Классификация карбоновых кислот. (Лекция 12) Применение алюминия и его сплава в машиностроении
Применение алюминия и его сплава в машиностроении Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота Виды присадок к моторным топливам. Бензин
Виды присадок к моторным топливам. Бензин Кислоты и их свойства
Кислоты и их свойства Массовая доля вещества в растворе
Массовая доля вещества в растворе Изменения, происходящие с белками в процессах технологической переработки сырья
Изменения, происходящие с белками в процессах технологической переработки сырья Камень чароит
Камень чароит Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Металлы. Свойства металлов
Металлы. Свойства металлов Фосфор и его соединения. Электронные формулы атома фосфора
Фосфор и его соединения. Электронные формулы атома фосфора Этот многоликий цинк
Этот многоликий цинк Альдегидтер
Альдегидтер