Содержание
- 2. Кремний вырисовывается в мироздании как элемент, обладающий исключительным значением. Вернадский В. И.
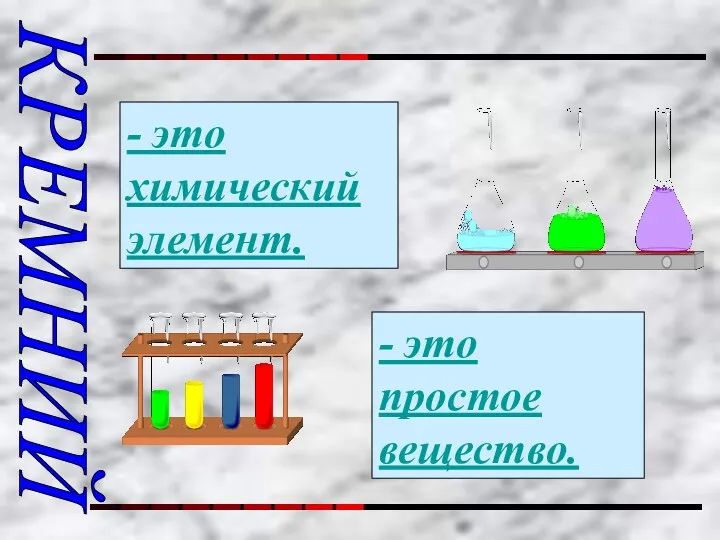
- 3. КРЕМНИЙ - это химический элемент. - это простое вещество.
- 4. I.3.История открытия В чистом виде кремний был выделен в 1811 году французскими учеными Жозефом Луи Гей-Люссаком
- 5. Порядковый Химический номер знак Относительная атомная масса I.Кремний-как ХЭ
- 6. В периодической системе Д.И.Менделеева,кремний находится в IV группе, главной подгруппы, III периода. Число протонов, электронов, нейтронов-
- 7. Схема распределения электронов в атоме: 14Si ) ) ) 2е 8е 4е Степени окисления: -4; 0;
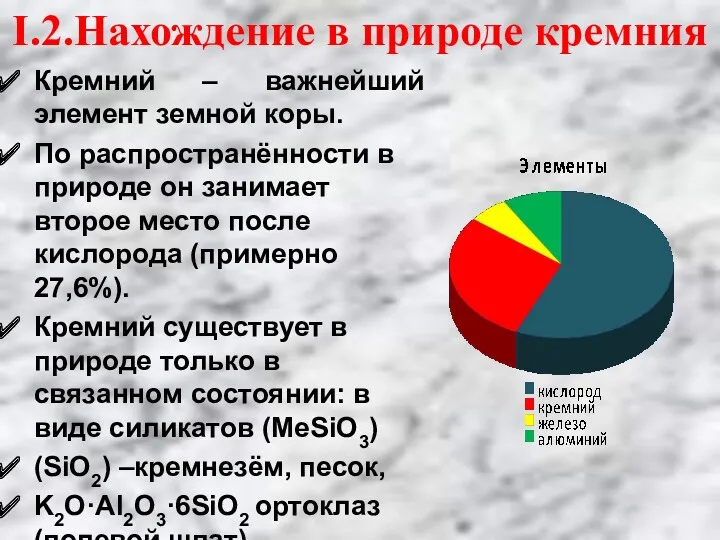
- 8. Кремний – важнейший элемент земной коры. По распространённости в природе он занимает второе место после кислорода
- 9. Белая глина Полевой шпат Слюда
- 10. Значительная часть природного кремния представлена оксидом кремния (IV). Свободного оксида кремния в земной коре около 12%,
- 11. Изумруд Топаз Аквамарин
- 12. - в промышленности В электрических печах при высокой температуре происходит восстановление кремния из его оксида коксом
- 13. Химическая формула- Относительная молекулярная масса- II.Кремний - простое вещество Si 28,086
- 14. II.1.Аллотропные модификации
- 15. Кремний кристаллический Кремний аморфный Тип химической связи: ковалентная неполярная Тип структуры кристаллической решётки: атомная
- 16. Структура кристаллической решётки
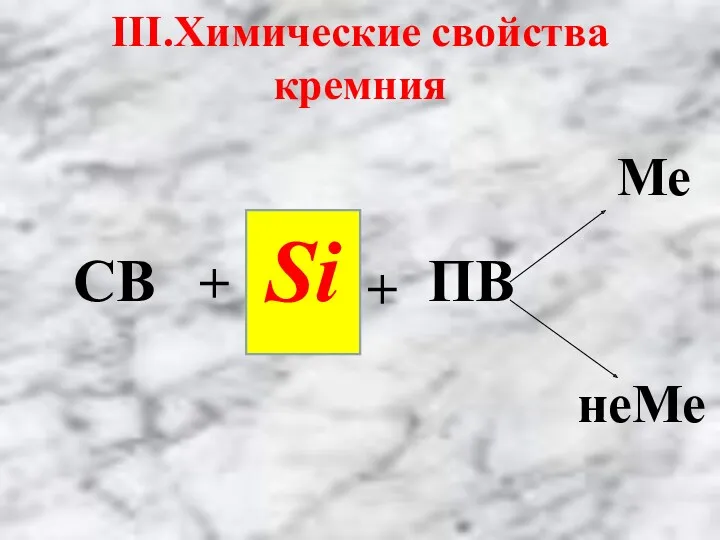
- 17. Ме СВ Si ПВ неМе III.Химические свойства кремния + +
- 18. Проявляет восстановительные свойства: Реагирует с простыми веществами – НеМе а) с галогенами: Si + 2Cl2 =
- 19. 3.Реагирует со сложными веществами : А) с кислотами: 3Si+12HF+4HNO3 =3SiF4+4NO +8H2O Б) со щелочами: Si+2NaOH+H2O =
- 20. Si Электротехнике Производство жаропрочных сталей Солнечные батареи V.Применение кремния
- 21. Высший оксид – SiO2 (оксид кремния (IV) ) Высший гидроксид – H2SiO3 (кремниевая к-та) Летучее соединение
- 22. Сравните оксид углерода CO2 и оксид кремния SiO2 CO2 SiO2 А.Газ, в воде растворяется Б.Твердое вещество,
- 23. Химические свойства оксида кремния Составить уравнения реакции 1.Взаимодействие оксида кремния с щелочами(KOH) VI.1. Оксид кремния(IV)- кислотный
- 24. VI.1. Оксид кремния(IV)- кислотный оксид Химические свойства оксида кремния Составить уравнения реакции 2.Взаимодействие оксида кремния с
- 25. VI.1. Оксид кремния(IV)- кислотный оксид Химические свойства оксида кремния Составить уравнения реакции 3.Взаимодействие оксида кремния с
- 26. VI.1. Оксид кремния(IV)- кислотный оксид Химические свойства оксида кремния Составить уравнения реакции 4.Взаимодействие оксида кремния с
- 27. nSiO2 ∙ mH2O поликремниевые кислоты H2SiO3 – кремниевая кислота. Слабая, непрочная, в воде малорастворима (образует коллоидный
- 28. Силикаты На силикаты приходится более 1/4 массы всей земной коры. К ним относится около 500 минералов,
- 29. Применение соединений кремния Стекло Оконное стекло Na2CO3 + CaCO3 + 6SiO2 = Na2O .CaO .6SiO2 Хрусталь
- 30. Керамика Применение соединений кремния Из керамики изготавливают изоляторы для высоковольтных ЛЭП и другие изделия, используемые в
- 31. Керамика - общее название многочисленных материалов, полученных при спекании глин с различными минеральными добавками. Значит, и
- 32. №1. Закончите уравнения практически осуществимых реакций: 1) SiO2 + MgO → 2) CaSiO3 + CO2 →
- 33. №2. Составьте молекулярные и, где это возможно, ионные уравнения реакций. Si→SiO2 →Na2SiO3 → H2SiO3→K2SiO3→СaSiO3 №3 Дано
- 34. Рефлексия 1.На уроке я работал… 2.Своей работой на уроке я… 3.Урок для меня показался… 4.За урок
- 36. Скачать презентацию





























 Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Виды коррозии
Виды коррозии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Нуклеин қышқылдары
Нуклеин қышқылдары Ртуть. Использование ртути
Ртуть. Использование ртути Художественная обработка камня
Художественная обработка камня Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Кристаллическое состояние вещества
Кристаллическое состояние вещества Биохимия нуклеиновых кислот
Биохимия нуклеиновых кислот Химические чистящие средства
Химические чистящие средства Химические вещества как строительные и поделочные материалы
Химические вещества как строительные и поделочные материалы Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9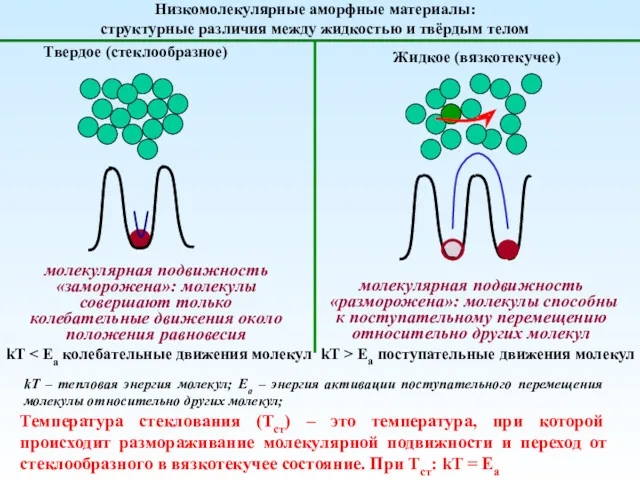 Механика полимеров
Механика полимеров Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) Химические реакции. Условия необходимые для протекания химических реакций?
Химические реакции. Условия необходимые для протекания химических реакций? Петрография
Петрография Смоги и их влияние на человека
Смоги и их влияние на человека Валентные возможности атомов. Степень окисления
Валентные возможности атомов. Степень окисления Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Качественные реакции на функциональные группы. Классификация функциональных групп
Качественные реакции на функциональные группы. Классификация функциональных групп Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Металлы. Общая характеристика
Металлы. Общая характеристика Минералогия литофильных редких элементов. Бор
Минералогия литофильных редких элементов. Бор Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД)