Содержание
- 2. Повторение изученного ранее Что такое атом? Что такое ион? Чем отличается ион от атома? Какие типы
- 3. Правила вычисления степени окисления (СО) элементов:
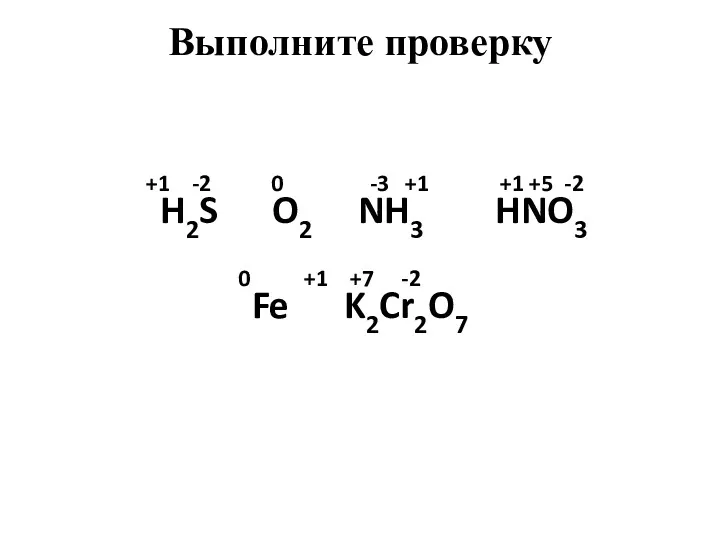
- 4. Определите степени окисления атомов химических элементов по формулам их соединений: H2S, O2, NH3, HNO3, Fe, K2Cr2O7
- 5. +1 -2 0 -3 +1 +1 +5 -2 H2S O2 NH3 HNO3 0 +1 +7 -2
- 6. Расставьте степени окисления элементов в реакциях. Сравните, как ведут себя степени окисления в процессе реакции. HCl
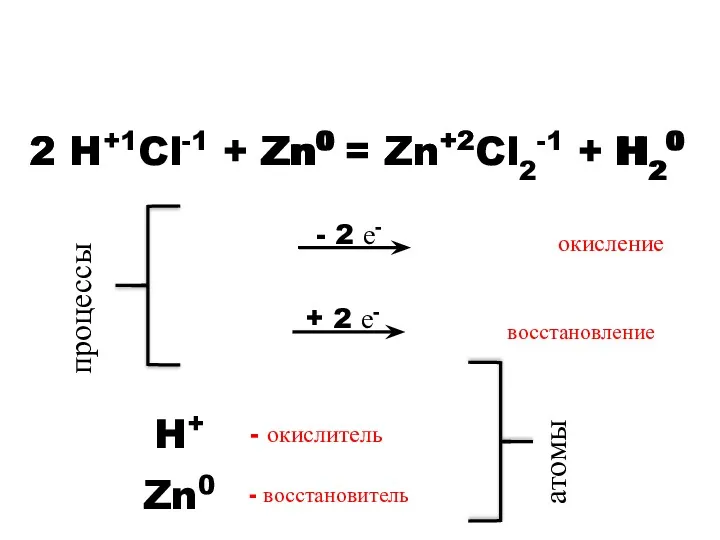
- 7. - 2 е- 2 H+1Cl-1 + Zn0 = Zn+2Cl2-1 + H20 Zn0 2 H+ Zn+2 H20
- 8. Окисление – процесс отдачи электронов. Восстановление – процесс присоединения электронов. Окислитель – элемент, принимающий электроны. Восстановитель
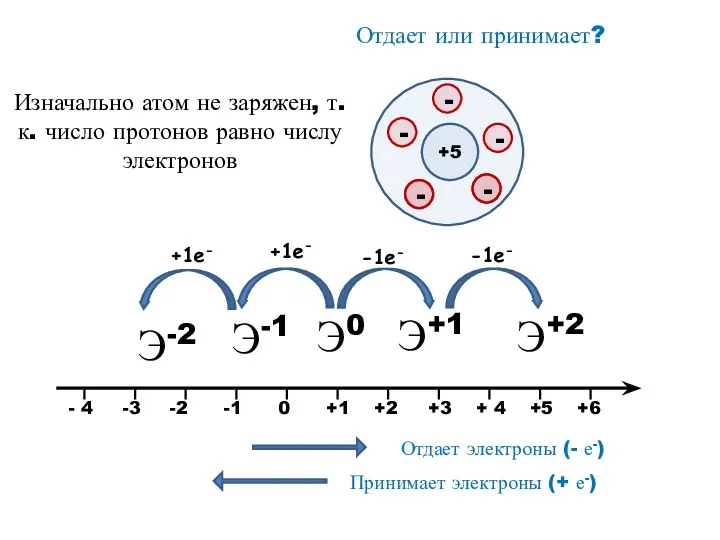
- 9. Э+1 Э+2 Э-2 Э-1 Отдает или принимает? +5 Изначально атом не заряжен, т.к. число протонов равно
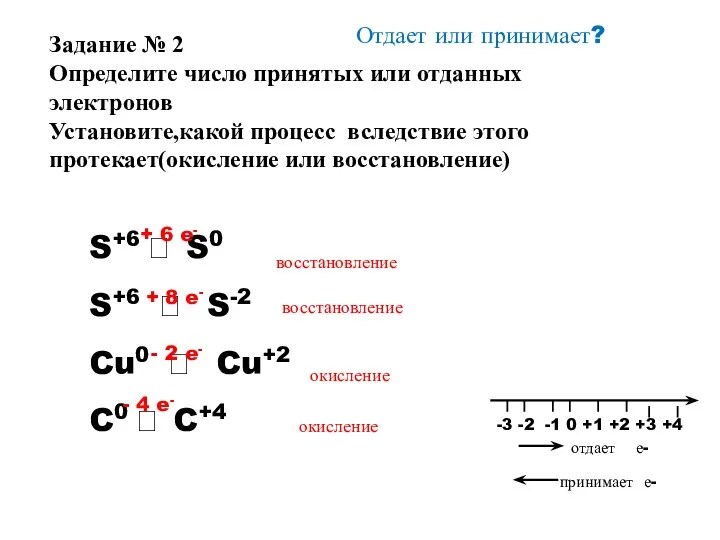
- 10. Отдает или принимает? S+6 ? S0 S+6 ? S-2 Cu0 ? Cu+2 C0 ? C+4 Задание
- 11. Отдает или принимает? S+6 ? S0 S+6 ? S-2 Cu0 ? Cu+2 C0 ? C+4 +
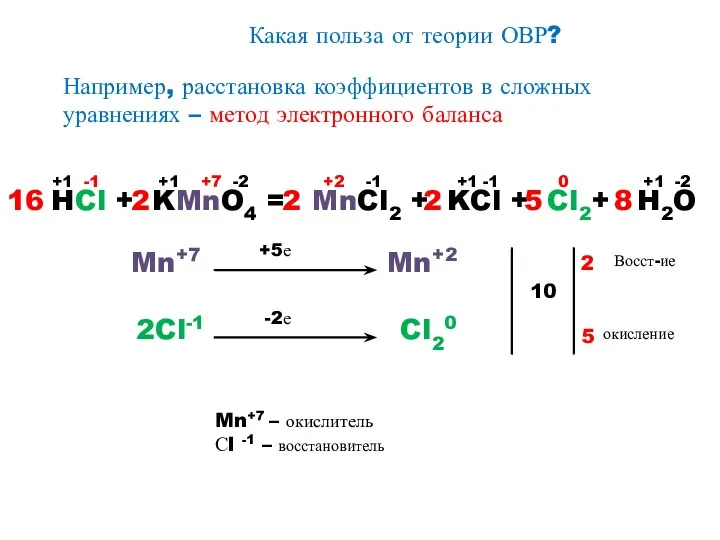
- 12. Какая польза от теории ОВР? Например, расстановка коэффициентов в сложных уравнениях – метод электронного баланса HCl
- 13. План составления уравнений ОВР и электронного баланса к ним 1. Записать схему реакции. 2. Определить, атомы
- 14. Физкультминутка
- 15. Вспомним правила техники безопасности При работе с кислотами необходимо помнить, что эти вещества опасны Оборудование должно
- 16. Это полезно знать Степени окисления элементов в составе аниона соли такие же, как и в кислоте,
- 17. На проявление окислительно-восстановительных свойств влияет такой фактор, как устойчивость молекулы или иона. Чем прочнее частица, тем
- 18. Например, азот имеет высокую электроотрицательность и мог бы быть сильным окислителем в виде простого вещества, но
- 19. Или НСLO более сильный окислитель в растворе, чем НСLO4, так как НСLO – менее устойчивая кислота.
- 20. Если химический элемент находится в промежуточной степени окисления, то он проявляет свойства и окислителя, и восстановителя.
- 21. Опыт №2 Нитрат серебра + Медь= AgNO3 + Cu → Cu(NO3)2 + Ag↓ Опыт №1 Карбонат
- 22. AgNO3 + Cu → Cu(NO3)2 + Ag↓ Ag+1 +1 e Ag0 Cu0 - 2 e Cu+2
- 23. ОВР в быту
- 24. Выяснить, как окислительно-восстановительные реакции применяются в быту. Цель работы:
- 25. Газ метан горит бесцветным пламенем с образованием воды и углекислого газа СН4+2О2=СО2+2Н2О Горение газа на кухне
- 26. При обработке персолью отбеливание происходит за счет окисления загрязнений 2H2O2=2H2O+O2. Для того чтобы образующийся кислород не
- 27. При взаимодействии железа и кислорода образуется ржавчина. 4Fe+ 2O2= 2Fe2O3 Коррозия металла
- 28. Мы часто сталкиваемся с окислительно-восстановительными реакциями в быту: при горении газа; при коррозии металлов; при отбеливании
- 29. Задание №3 Выполните 1. Из приведенных схем уравнений реакций выпишите те, которые можно отнести к ОВР
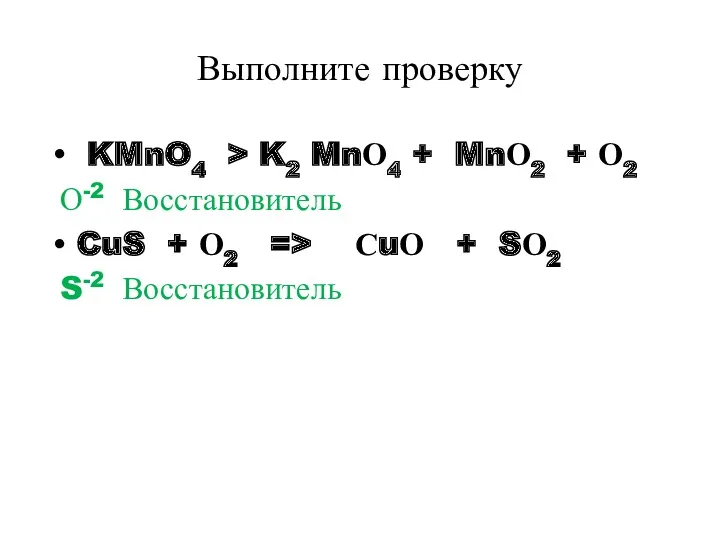
- 30. Выполните проверку KMnO4 > K2 MnО4 + MnО2 + О2 О-2 Восстановитель CuS + О2 =>
- 31. Задание №4 (самоконтроль)
- 35. Скачать презентацию


























 Классификация автомобильных масел
Классификация автомобильных масел Химическая связь
Химическая связь Жёсткость воды и способы её устранения
Жёсткость воды и способы её устранения Химические добавки к бетонам
Химические добавки к бетонам Ауыл шаруашылығындағы пестицидтер
Ауыл шаруашылығындағы пестицидтер Оксиды, их классификация и свойства
Оксиды, их классификация и свойства Общая характеристика металлов. Металлическая связь
Общая характеристика металлов. Металлическая связь Металлы и Неметаллы
Металлы и Неметаллы Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Ознайомлення зі зразками пластмас. Практична робота №4
Ознайомлення зі зразками пластмас. Практична робота №4 Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Свойства кислот Сульфура H2SO4, H2SO3, H2S
Свойства кислот Сульфура H2SO4, H2SO3, H2S Сорбционные процессы
Сорбционные процессы Циклоалканы. Строение алициклов
Циклоалканы. Строение алициклов Металдардың химиялық белсенділігі
Металдардың химиялық белсенділігі Оксиды и гидроксиды
Оксиды и гидроксиды Органические соединения серы
Органические соединения серы Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Алкины. Самостоятельная работа
Алкины. Самостоятельная работа Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Crystal defects and imperfections
Crystal defects and imperfections Особенности строения соединений органической химии. 10 класс
Особенности строения соединений органической химии. 10 класс Витамины
Витамины Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Формы нахождения минералов в природе
Формы нахождения минералов в природе Растворы электролитов
Растворы электролитов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции