Содержание
- 2. в) спирановые системы (общий узловой атом): Спиро[4,5]декан [x,y] – число углеродных атомов от узлового атома углерода
- 3. Строение алициклов Особенность алициклов в наличии напряжения (исчезает с С14 (циклотетрадекан)). Виды напряжений в циклах: 1.
- 4. 3. Взаимодействие (Ван-дер-Ваальса) между пространственно сближенными атомами заместителей или цикла (транс-аннулярное взаимодействие) Определяется по теплоте сгорания,
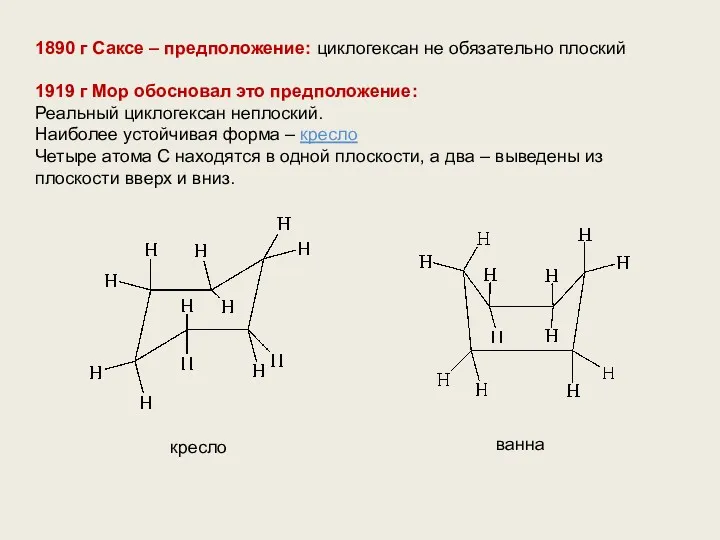
- 5. 1890 г Саксе – предположение: циклогексан не обязательно плоский 1919 г Мор обосновал это предположение: Реальный
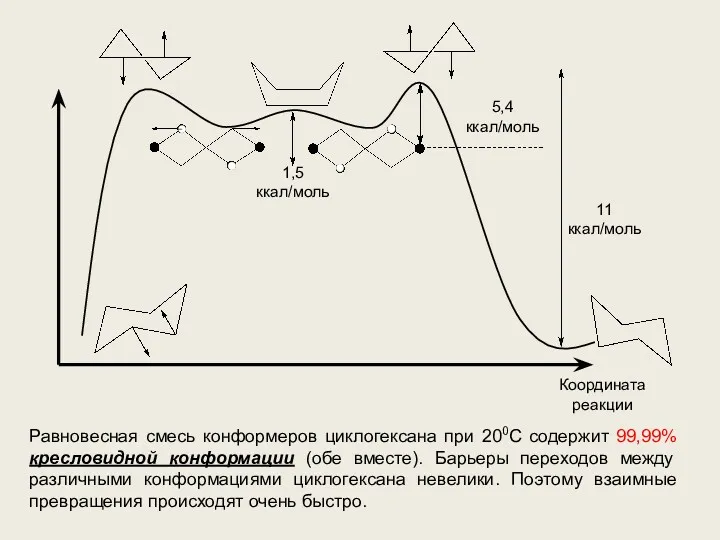
- 6. 1,5 ккал/моль 5,4 ккал/моль 11 ккал/моль Координата реакции Равновесная смесь конформеров циклогексана при 200С содержит 99,99%
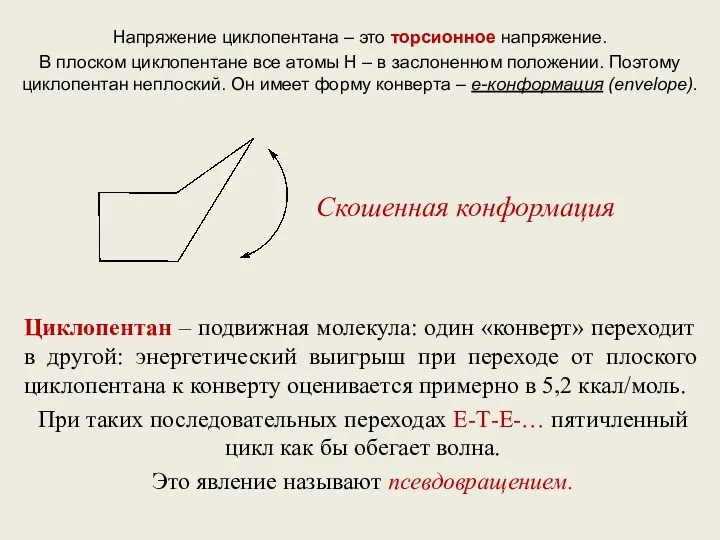
- 7. Напряжение циклопентана – это торсионное напряжение. В плоском циклопентане все атомы Н – в заслоненном положении.
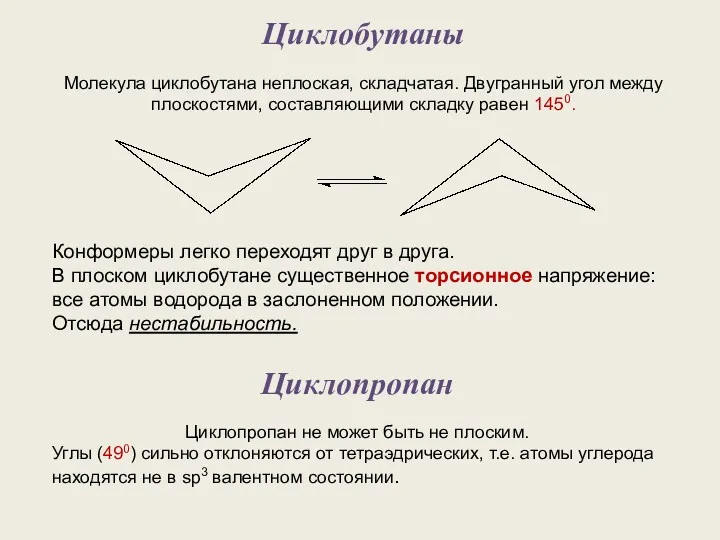
- 8. Циклобутаны Молекула циклобутана неплоская, складчатая. Двугранный угол между плоскостями, составляющими складку равен 1450. Конформеры легко переходят
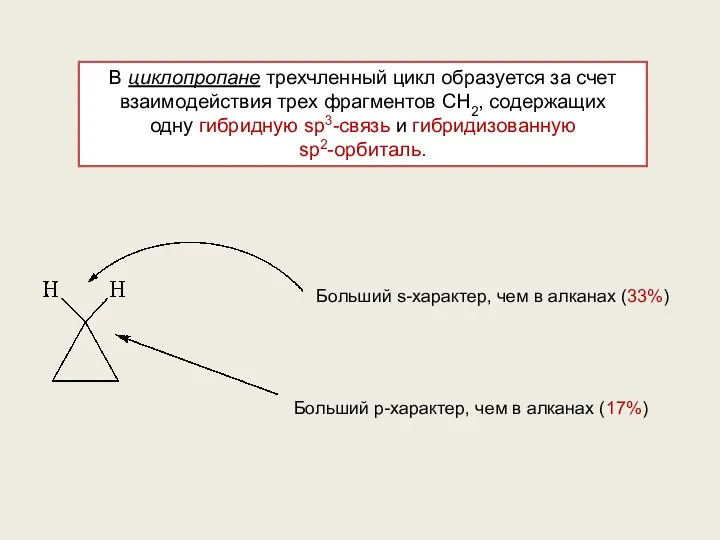
- 9. В циклопропане трехчленный цикл образуется за счет взаимодействия трех фрагментов CH2, содержащих одну гибридную sp3-связь и
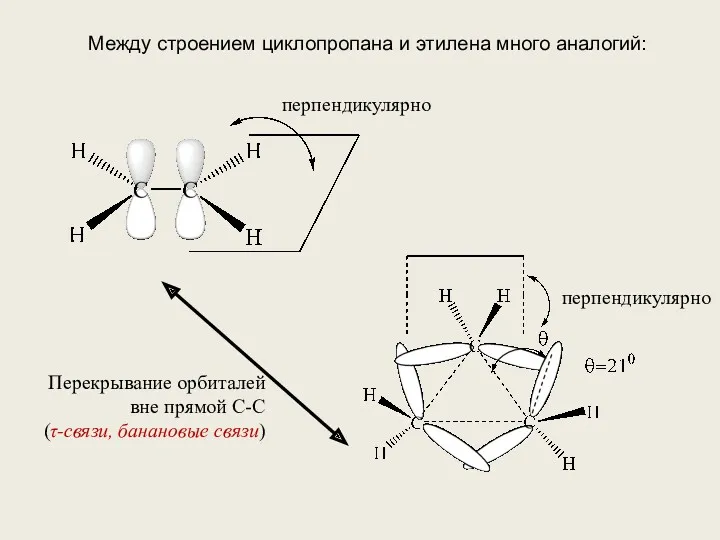
- 10. Между строением циклопропана и этилена много аналогий: перпендикулярно перпендикулярно Перекрывание орбиталей вне прямой С-С (τ-связи, банановые
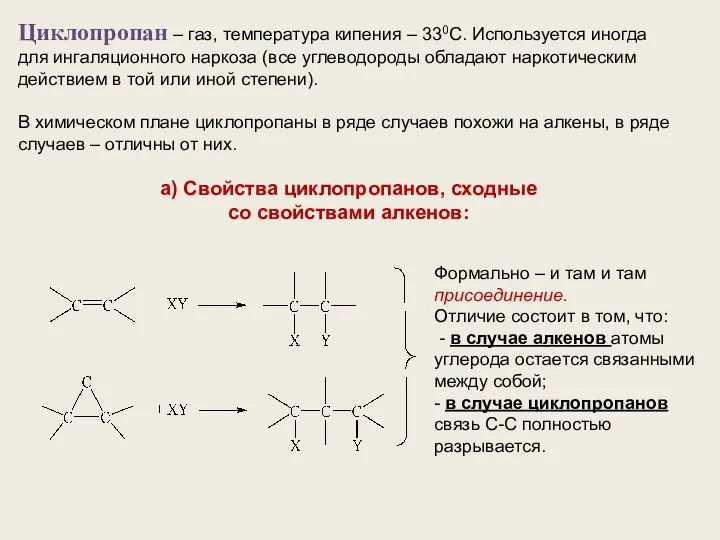
- 11. Циклопропан – газ, температура кипения – 330С. Используется иногда для ингаляционного наркоза (все углеводороды обладают наркотическим
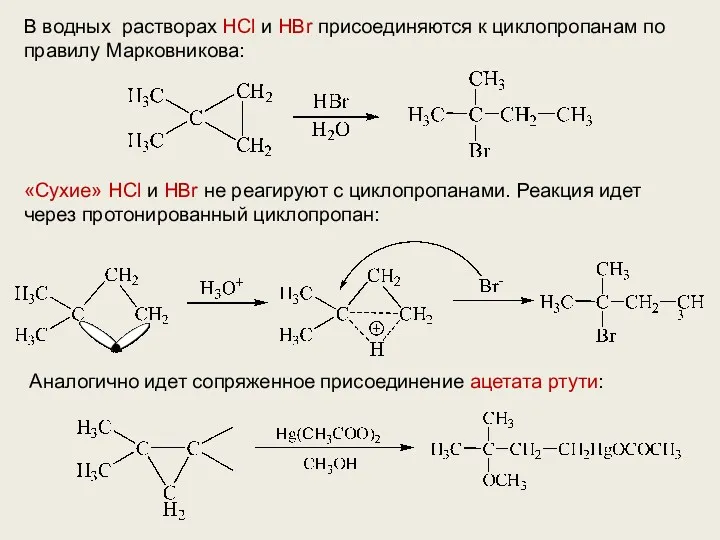
- 12. В водных растворах HCl и HBr присоединяются к циклопропанам по правилу Марковникова: «Сухие» HCl и HBr
- 13. Циклопропан реагирует при облучении с хлором, давая как продукты замещения, так и раскрытия цикла. С бромом
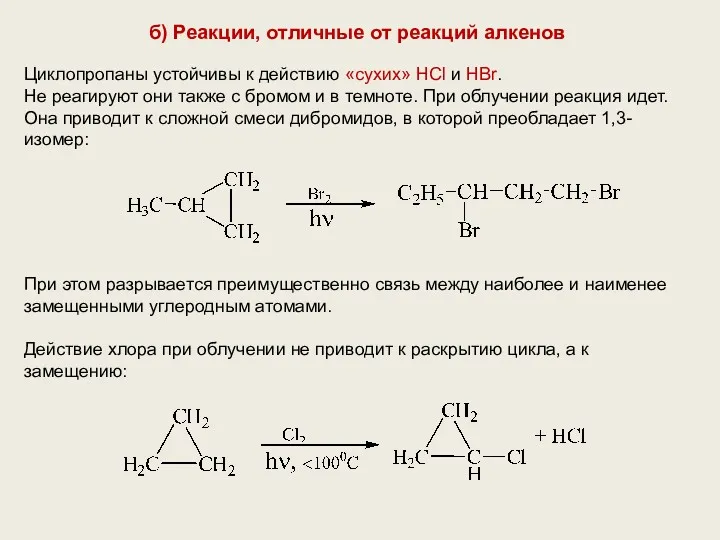
- 14. б) Реакции, отличные от реакций алкенов Циклопропаны устойчивы к действию «сухих» HCl и HBr. Не реагируют
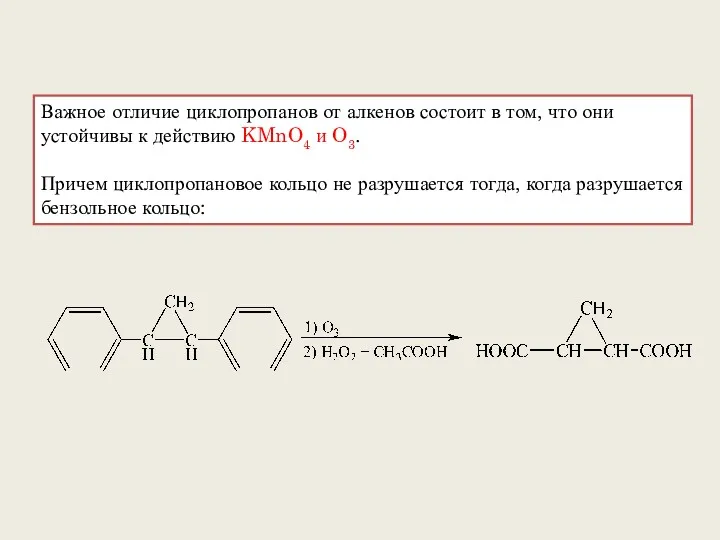
- 15. Важное отличие циклопропанов от алкенов состоит в том, что они устойчивы к действию KMnO4 и O3.
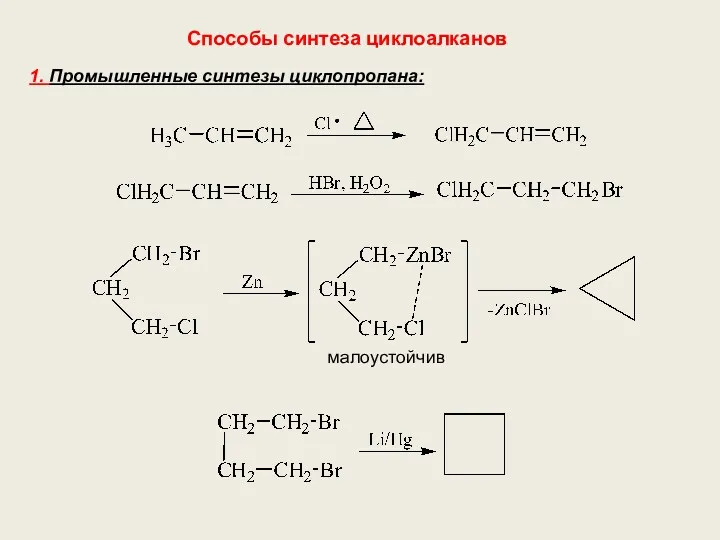
- 16. Способы синтеза циклоалканов 1. Промышленные синтезы циклопропана: малоустойчив
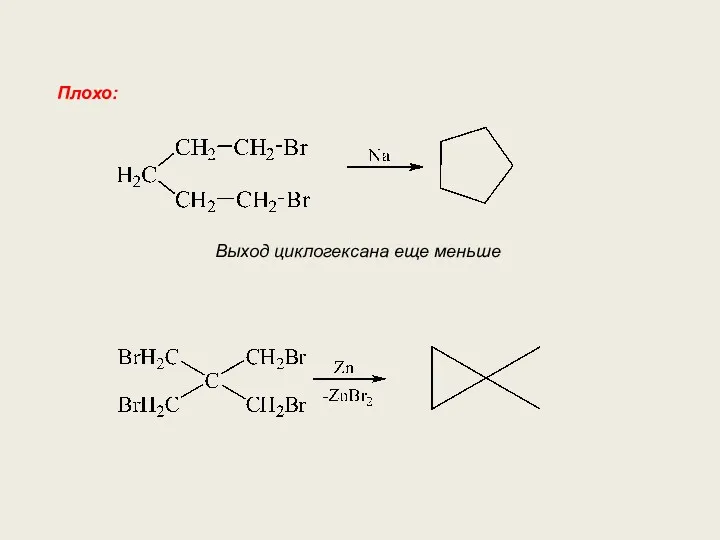
- 17. Плохо: Выход циклогексана еще меньше
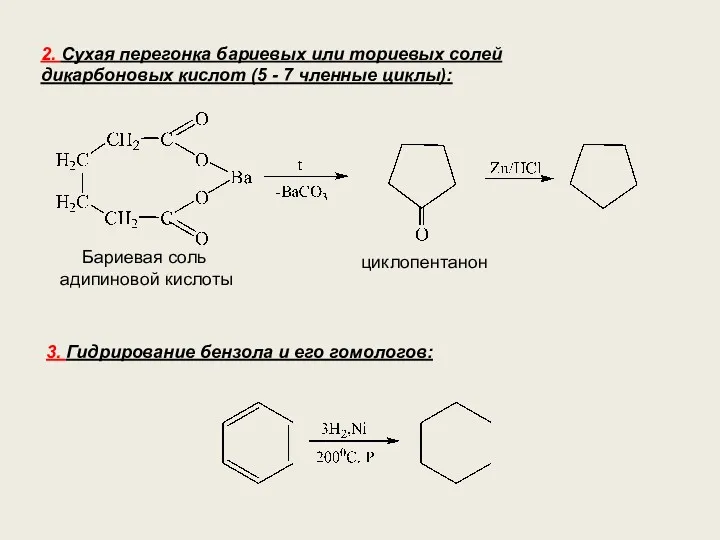
- 18. 2. Сухая перегонка бариевых или ториевых солей дикарбоновых кислот (5 - 7 членные циклы): циклопентанон Бариевая
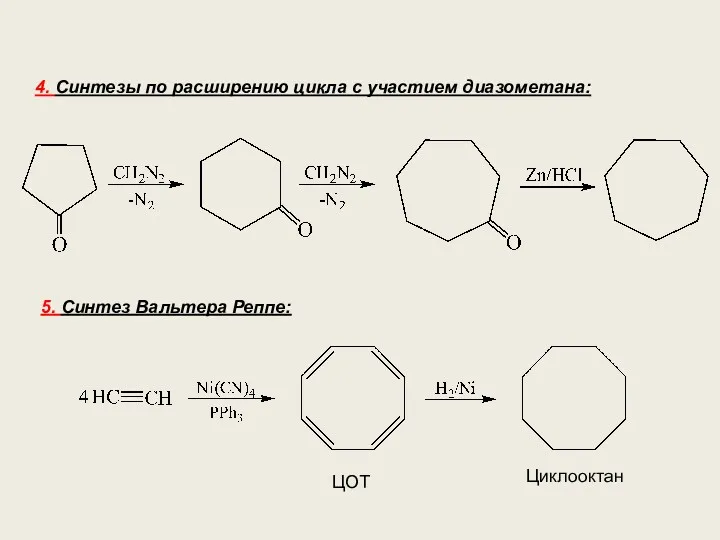
- 19. 4. Синтезы по расширению цикла с участием диазометана: 5. Синтез Вальтера Реппе: ЦОТ Циклооктан
- 21. Скачать презентацию
![в) спирановые системы (общий узловой атом): Спиро[4,5]декан [x,y] – число](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/187028/slide-1.jpg)



 Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Качественные реакции на анионы
Качественные реакции на анионы Застосування радіонуклідів у медицині, тваринництві та археології
Застосування радіонуклідів у медицині, тваринництві та археології Химическая технология. Введение
Химическая технология. Введение Загальні способи добування солей. Класифікація неорганічних речовин
Загальні способи добування солей. Класифікація неорганічних речовин Электролитическая диссоциация
Электролитическая диссоциация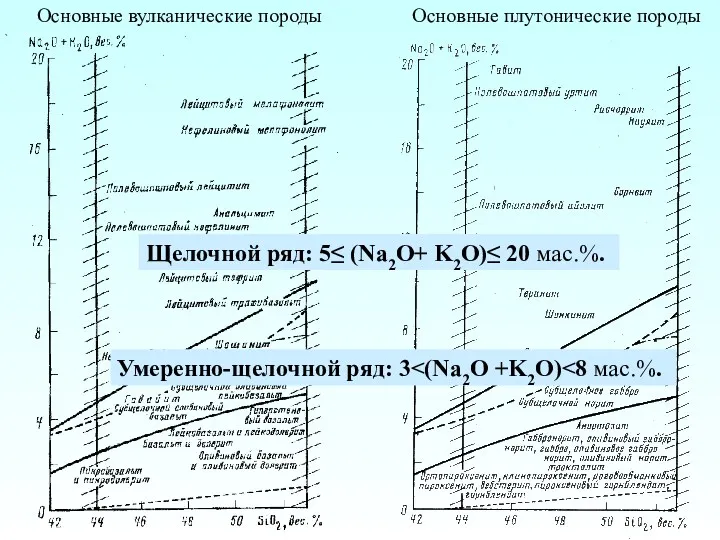 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Метод МО
Метод МО Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Аммиак. Физические и химические свойства. Получение, применение
Аммиак. Физические и химические свойства. Получение, применение Ерітінділер туралы ілім. Буферлік ерітінділер
Ерітінділер туралы ілім. Буферлік ерітінділер Гидролиз. Применение гидролиза. (11 класс)
Гидролиз. Применение гидролиза. (11 класс) Электронно-ионный баланс и Закон Авогадро. 8 класс
Электронно-ионный баланс и Закон Авогадро. 8 класс Атом. Будова атома
Атом. Будова атома Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Алканы нефти. Содержание алканов в нефтяных фракциях
Алканы нефти. Содержание алканов в нефтяных фракциях Растворы. Лекция 7
Растворы. Лекция 7 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Виды химической связи
Виды химической связи Профілактика захворювань незбалансованого харчування. Харчові добавки
Профілактика захворювань незбалансованого харчування. Харчові добавки Первая группа периодической системы Менделеева. Щелочные металлы
Первая группа периодической системы Менделеева. Щелочные металлы Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical
Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical Чистые вещества и смеси
Чистые вещества и смеси