Содержание
- 2. Строение атомов щелочных металлов Элементы I группы главной подгруппы носят общее название щелочные металлы, т.к. при
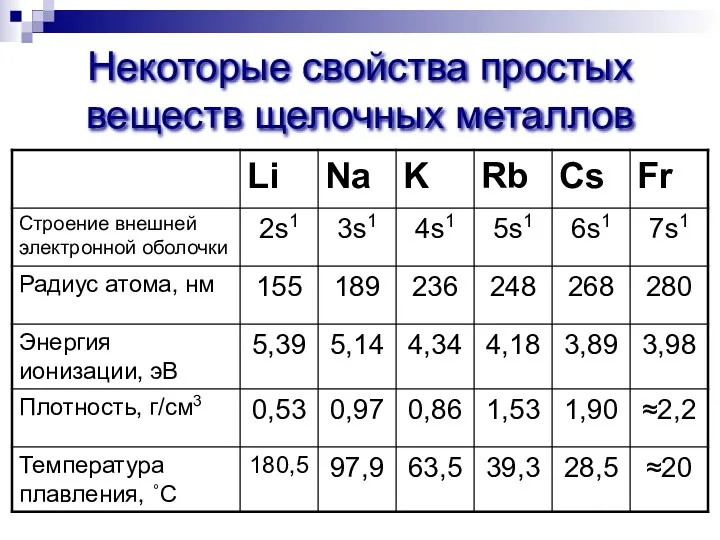
- 3. Некоторые свойства простых веществ щелочных металлов
- 4. Нахождение в природе В природе встречаются только в виде соединений Наиболее распространены K и Na. Rb
- 5. Галлит NaCl
- 6. Cильвин KCl
- 7. Сильвинит KCl·NaCl
- 8. Мирабилит Na2SO4·10H2O Большие количества сульфата натрия находятся в заливе Каспийского моря, где эта соль толстым слоем
- 9. Нахколит NaHCO3
- 10. Карналлит КCl∙MgCl2∙6H2O
- 11. Получение Na, K и Li получают электролизом расплавов соединений 2NaCl → 2Na + Cl2 Rb и
- 12. Химические свойства Взаимодействие с водой 2K + 2H2O = 2KOH + H2↑ Взаимодействие с водородом (при
- 13. Химические свойства Взаимодействуют с галогенами 2Na + Сl2 = 2NaCl С жидким чистым аммиаком щелочные металлы
- 14. Химические свойства Взаимодействуют с кислотами 6Na + 4H2SO4 = S + 3Na2SO4 + 4H2O Na +
- 15. Характеристические соединения Гидриды. Наиболее устойчив гидрид лития. Все гидриды энергично разлагаются водой: LiH + H2O =
- 16. Характеристические соединения Гидроксиды. В технике носят название едкие щелочи. В расплавленном состоянии взаимодействуют со стеклом, фарфором,
- 17. Характеристические соединения в) Электролиз растворов хлоридов щелочных металлов: 2NaСl + H2O = 2NaOH + H2 +
- 18. Характеристические соединения Химические свойства гидроксидов Хорошо растворимы в воде, являются сильными основаниями. Менее, чем другие гидроксиды,
- 19. Характеристические соединения Соли NaCl (поваренная соль) содержится в морской воде (в среднем 2,7%) и в виде
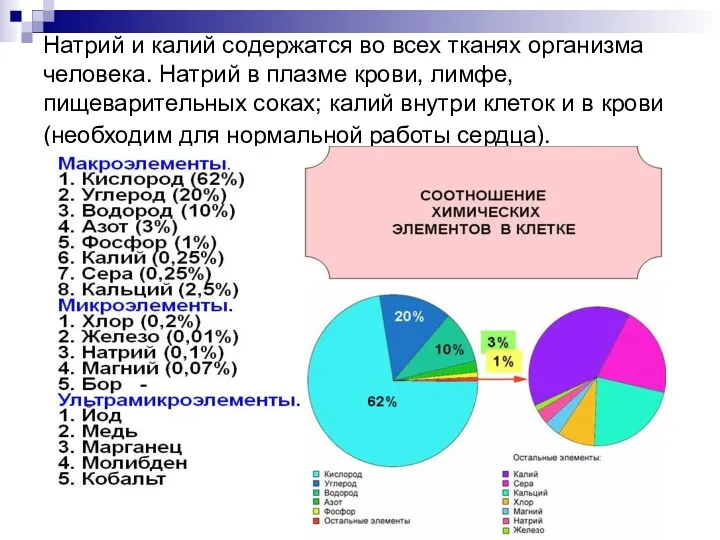
- 20. Натрий и калий содержатся во всех тканях организма человека. Натрий в плазме крови, лимфе, пищеварительных соках;
- 21. I группа Периодической системы Побочная подгруппа
- 22. Степени окисления
- 23. Важнейшие минералы меди халькопирит (медный колчедан) CuFeS2 халькозин Cu2S куприт Cu2O азурит Cu3(CO3)2(OH)2 малахит (CuOH)2CO3 Медь
- 24. Среднее содержание серебра в земной коре — 70 мг/т. Серебро встречается в самородном состоянии и в
- 25. В земной кроме золота содержится очень мало, всего по массе около 4,3·10–7 %. Иногда золото может
- 26. На влажном воздухе медь окисляется, образуя основный карбонат меди(II): C разбавленной хлороводородной кислотой в присутствии кислорода:
- 27. Серебро Растворяется в хлорном железе, что применяется для травления: Во влажном воздухе образуется налёт: Галогены легко
- 28. Из чистых кислот золото растворяется только в горячей концентрированной селеновой кислоте: Золото реагирует с кислородом и
- 29. Применение Ag Для пайки; Производство зеркал; Фото- и кинопромышленность; Атомная служба; Стерилизация питьевой воды; Медицина; Защитные
- 31. Скачать презентацию


























 Аммиак
Аммиак Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Растворы. (Лекция 7)
Растворы. (Лекция 7) Значение периодического закона и периодической системы Д.И. Менделеева
Значение периодического закона и периодической системы Д.И. Менделеева Дисперсные системы. 11 класс
Дисперсные системы. 11 класс Техника безопасности на уроках химии. Решение экспериментальных задач по теме Неметаллы. Практическая работа №2
Техника безопасности на уроках химии. Решение экспериментальных задач по теме Неметаллы. Практическая работа №2 Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Общие способы получения металлов
Общие способы получения металлов Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Решение заданий по теме: Оксиды
Решение заданий по теме: Оксиды Фотохимический смог
Фотохимический смог Корунд. Разновидности корунда
Корунд. Разновидности корунда Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс
Анализ пищевых добавок (маркировка Е) используемых в продуктовой линейке Витамакс Искусственная радиоактивность. Ядерное оружие и его поражающие факторы
Искусственная радиоактивность. Ядерное оружие и его поражающие факторы Амины - производные аммиака
Амины - производные аммиака Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов
Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов Растворы
Растворы Водно-химический режим ТЭС. Основные задачи, организация и виды ВХР. Предотвращение коррозии, борьба с отложениями
Водно-химический режим ТЭС. Основные задачи, организация и виды ВХР. Предотвращение коррозии, борьба с отложениями 20231228_himicheskiy_sostav_kletki_wecompress.com_
20231228_himicheskiy_sostav_kletki_wecompress.com_ Мило та миловаріння
Мило та миловаріння Органические кислоты и основания. Лекция 6
Органические кислоты и основания. Лекция 6 Дисперсные системы
Дисперсные системы В мире химии. Периодический закон и ПСХЭ
В мире химии. Периодический закон и ПСХЭ Аммиак. Состав. Строение
Аммиак. Состав. Строение Химическая термодинамика
Химическая термодинамика Огнетушащие средства и механизмы прекращения горения ими. Тема-8
Огнетушащие средства и механизмы прекращения горения ими. Тема-8 Химия. ЕГЭ. Задание № 32
Химия. ЕГЭ. Задание № 32 Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях