Содержание
- 2. Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных
- 3. По некоторым другим сведениям, аммиак мог получить современное название от древнеегипетского слова «амониан». Так называли всех
- 4. Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый-химик, академик
- 5. История открытия аммиака Аммиак был получен в чистом виде в 1774 г. английским химиком Джозефом Луи
- 6. 1723-1802 г. В 1784 французский химик Бертолле разложением аммиака доказал его элементный состав, который в 1787
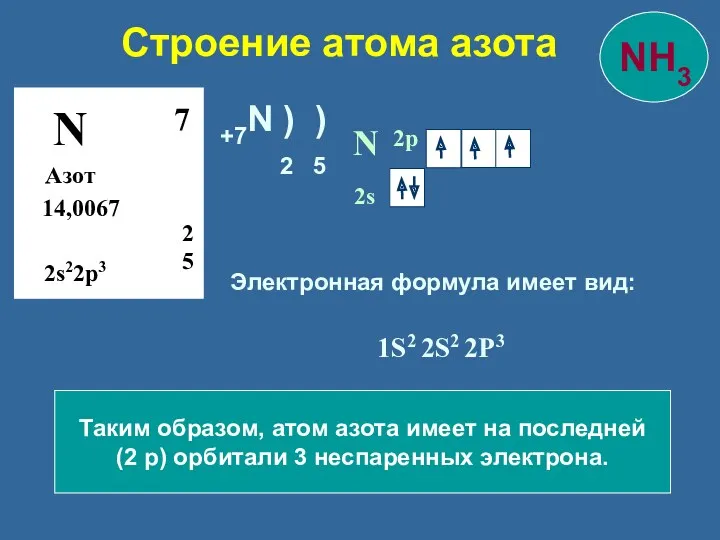
- 7. Строение атома азота N Азот 14,0067 2 5 7 2s22p3 N 2s 2p Таким образом, атом
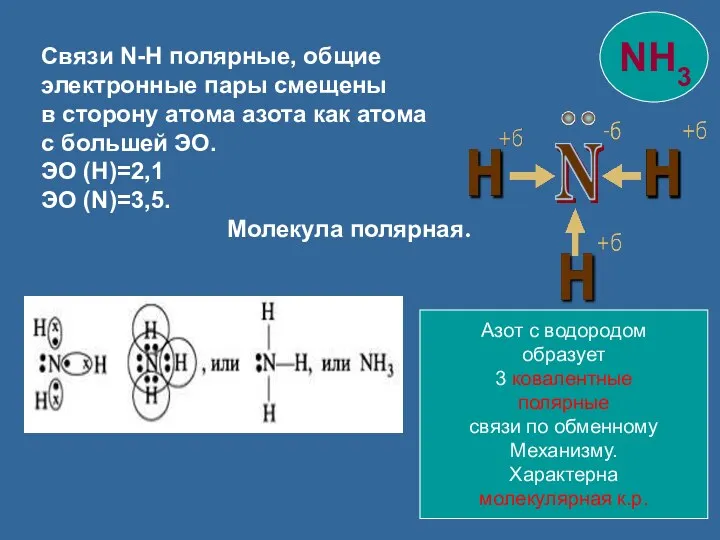
- 8. Связи N-H полярные, общие электронные пары смещены в сторону атома азота как атома с большей ЭО.
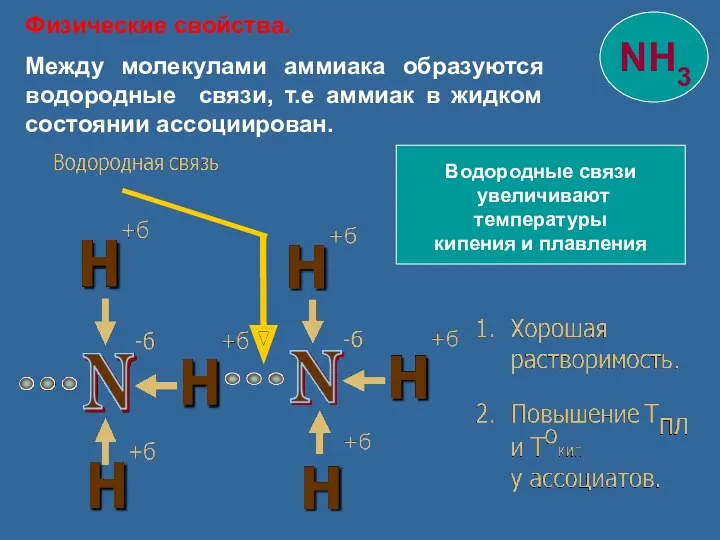
- 9. Водородные связи увеличивают температуры кипения и плавления Физические свойства. Между молекулами аммиака образуются водородные связи, т.е
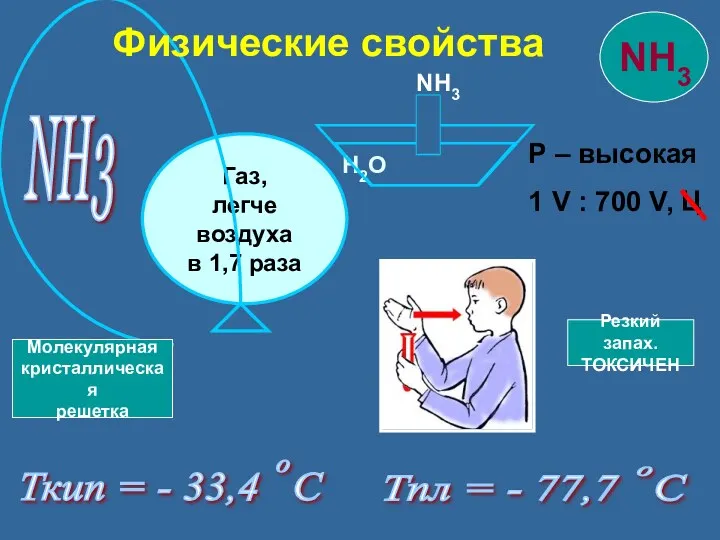
- 10. NH3 Р – высокая 1 V : 700 V, Ц Ткип = - 33,4 С Тпл
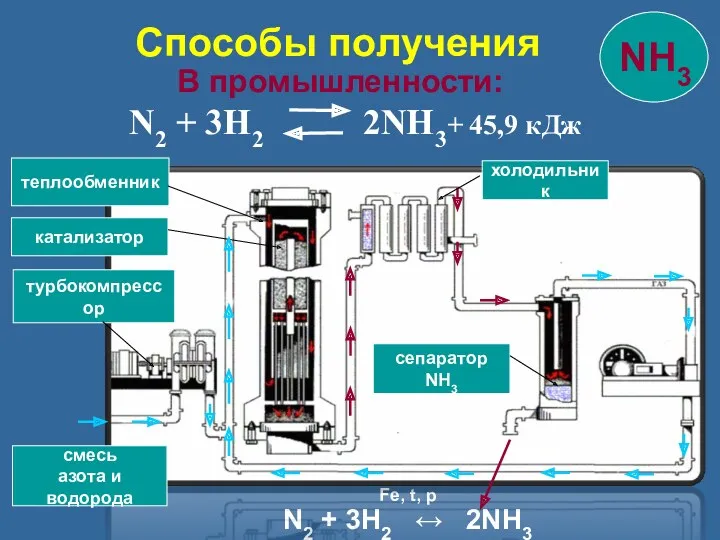
- 11. В промышленности: N2 + 3H2 2NH3+ 45,9 кДж смесь азота и водорода турбокомпрессор катализатор теплообменник холодильник
- 12. В лаборатории: 1. Действием щелочей на соли аммония: 2. Гидролиз нитридов:
- 13. :NH3 – низшая степень окисления азота. -3 Аммиак – восстановитель 2. Основные свойства (неподеленная пара электронов)
- 14. Реакция горения аммиака (до N2): 4NH3 + 3O2 = 2N2+ 6H2O = Аммиак-восстановитель
- 15. Каталитическое окисление аммиака (до NO): 4NH3 + 5O2 = 4NO + 6H2O Аммиак-восстановитель
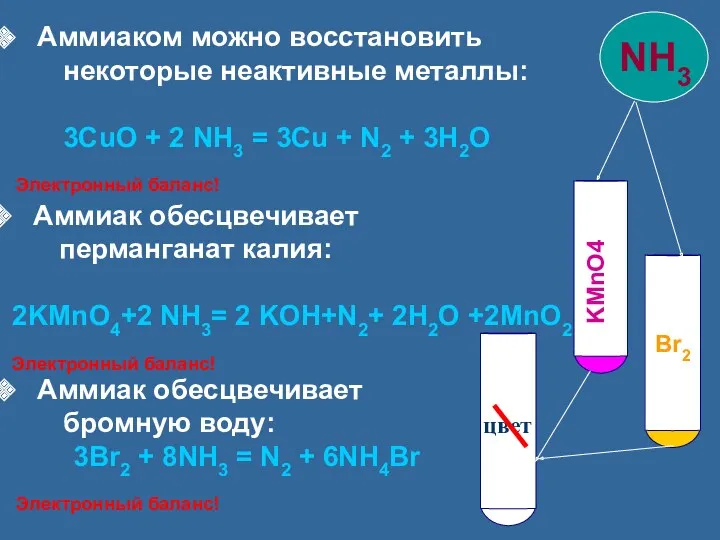
- 16. Аммиаком можно восстановить некоторые неактивные металлы: 3CuO + 2 NH3 = 3Cu + N2 + 3H2O
- 17. Аммиак реагирует с водой, образуя гидроксид аммония (аммиачная вода): NH3 + H2O ↔NH4OH Изменяет окраску индикаторов:
- 18. NH3 + HCl → NH4Cl хлорид аммония (нашатырь) 2 NH3 + H2SO4 → (NH4)2 SO4 сульфат
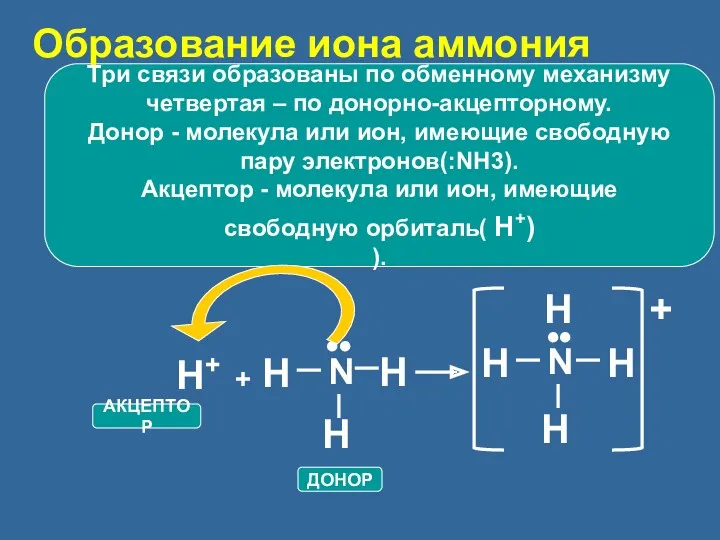
- 19. Три связи образованы по обменному механизму четвертая – по донорно-акцепторному. Донор - молекула или ион, имеющие
- 20. Специфические свойства 1. Взаимодействие с гипохлоритом натрия (образование гидразина): 2NH3 + NaClO = N2H4 + NaCl+H2O
- 21. Специфические свойства 2. Взаимодействие с активными металлами (образование амидов): 2NH3 + 2К = 2KNH2 + Н2
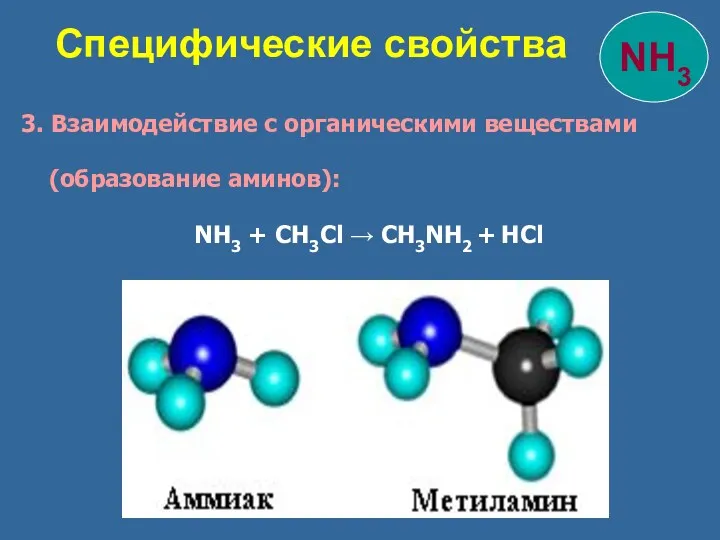
- 22. 3. Взаимодействие с органическими веществами (образование аминов): NH3 + CH3Cl → CH3NH2 + HCl Специфические свойства
- 23. 4. Комплексообразование: CuSO4 + 4NH3 → [Cu(NH3)4]SO4 Cu(OH)2+ 4NH3 → [Cu(NH3)4](OH)2 Специфические свойства Благодаря своим электронодонорным
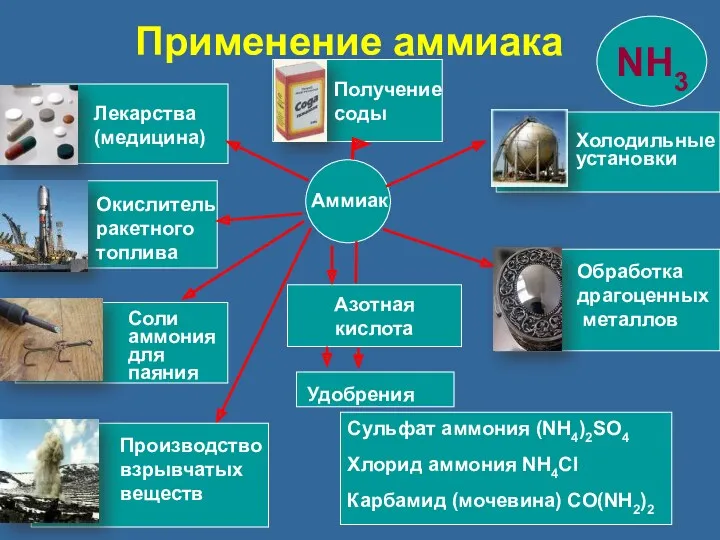
- 24. Азотная кислота Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиак Удобрения Лекарства (медицина) Окислитель
- 25. Техногенные катастрофы
- 26. 1. Нельзя прикасаться к разлитому веществу, это может вызвать болезненный ожог кожных покровов. 2. При отравлении
- 27. Правильно! Ошибка Ошибка Ошибка 1 кислот солей оксидов оснований 2 Ошибка Правильно! Ошибка Ошибка щелочами кислотами
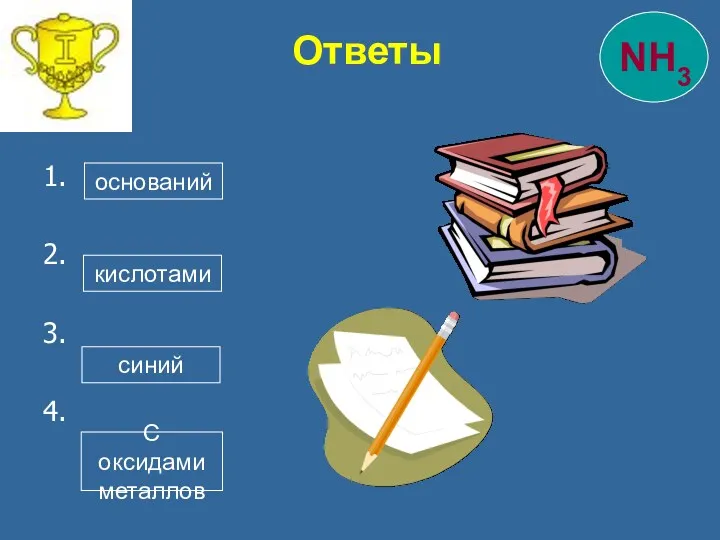
- 28. 1. 2. 3. 4. Ответы оснований кислотами синий С оксидами металлов
- 29. Осуществите цепочку превращений: N2?NH3?(NH4)2SO4?NH4Cl?NH3 ?N2 ? Li3N ? NH3 Готовимся к экзамену Запишите уравнения реакций. Где
- 30. Решите задачи: Уровень А: Какой объем аммиака можно получить при нагревании 7,4 г. гидроксида кальция с
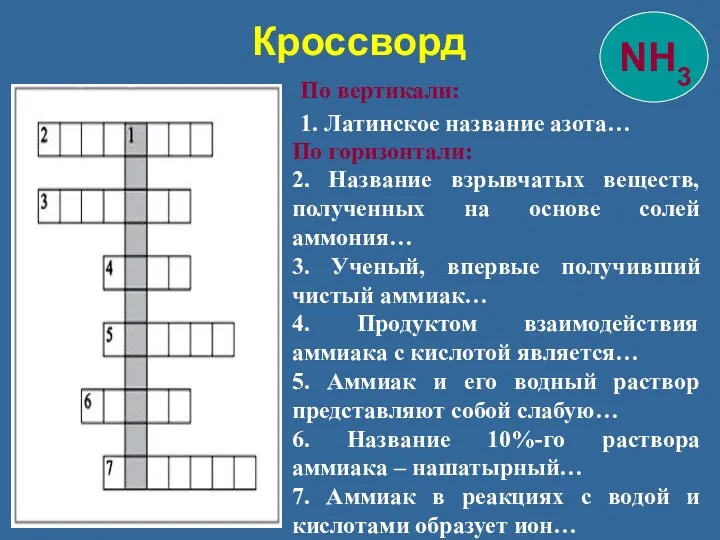
- 31. Кроссворд По вертикали: 1. Латинское название азота… По горизонтали: 2. Название взрывчатых веществ, полученных на основе
- 33. Скачать презентацию













![4. Комплексообразование: CuSO4 + 4NH3 → [Cu(NH3)4]SO4 Cu(OH)2+ 4NH3 →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/596135/slide-22.jpg)





 Углеводы. Моносахариды. Дисахариды. Полисахариды
Углеводы. Моносахариды. Дисахариды. Полисахариды Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2)
Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Физико-химические процессы в тропосфере. Температурные инверсии. Смог в атмосфере городов. Аэрозоли
Физико-химические процессы в тропосфере. Температурные инверсии. Смог в атмосфере городов. Аэрозоли Периодический закон и свойства химических элементов
Периодический закон и свойства химических элементов Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Амины. Анилин
Амины. Анилин Кристаллические и аморфные тела
Кристаллические и аморфные тела Уравнения химических реакций
Уравнения химических реакций Методы очистки натрия от примесей
Методы очистки натрия от примесей Галогены. Применение галогенов и их соединений
Галогены. Применение галогенов и их соединений Закон Авогадро. Молярный объем газов
Закон Авогадро. Молярный объем газов Экстракция. Понятия в экстракции
Экстракция. Понятия в экстракции Определение физических свойств минералов
Определение физических свойств минералов Предмет химии. Вещества
Предмет химии. Вещества Альдегиды и кетоны
Альдегиды и кетоны Адсорбция. Физическая и химическая адсорбция
Адсорбция. Физическая и химическая адсорбция Альдегиды и кетоны
Альдегиды и кетоны Химические элементы
Химические элементы Углеводы: классификация, строение и физико-химические свойства
Углеводы: классификация, строение и физико-химические свойства Тема 2. Электронный энергетический спектр как фундаментальная характеристика твердого тела. Перестройка энергетического спектра
Тема 2. Электронный энергетический спектр как фундаментальная характеристика твердого тела. Перестройка энергетического спектра Соли. Классификация и свойства солей
Соли. Классификация и свойства солей Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах
Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах Кремний и его соединения
Кремний и его соединения Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Alkaline earth metals
Alkaline earth metals Нурахмет А Защита ДП
Нурахмет А Защита ДП Классы неорганических соединений. 8 класс
Классы неорганических соединений. 8 класс