Содержание
- 2. Периодический закон и свойства химических элементов Структура периодической системы. Периодический закон. Закономерности изменения различных свойств элементов
- 3. 1869 г. Д. И. Менделеев сформулировал периодический закон: "Свойства элементов, а потому и свойства образуемых ими
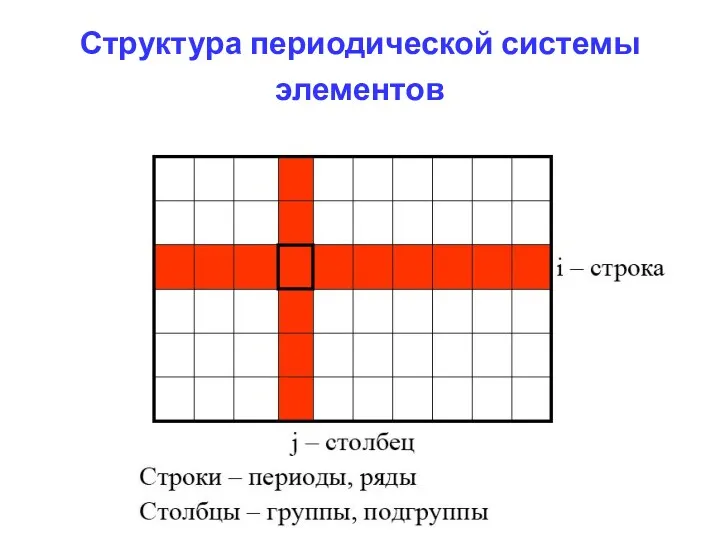
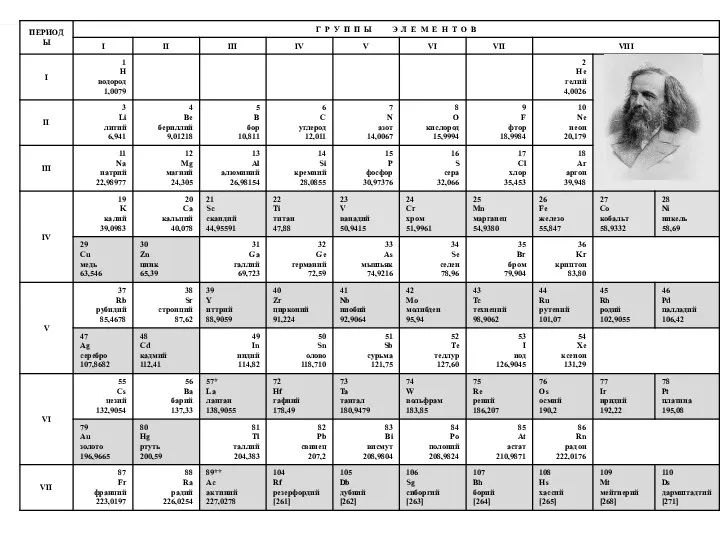
- 4. Структура периодической системы элементов
- 7. Деление элементов на группы и подгруппы зависит от структуры двух внешних слоев. В соответствии с количеством
- 8. Согласно правилу Клечковского, заселение электронами энергетических уровней и подуровней происходит с увеличением порядкового номера элемента в
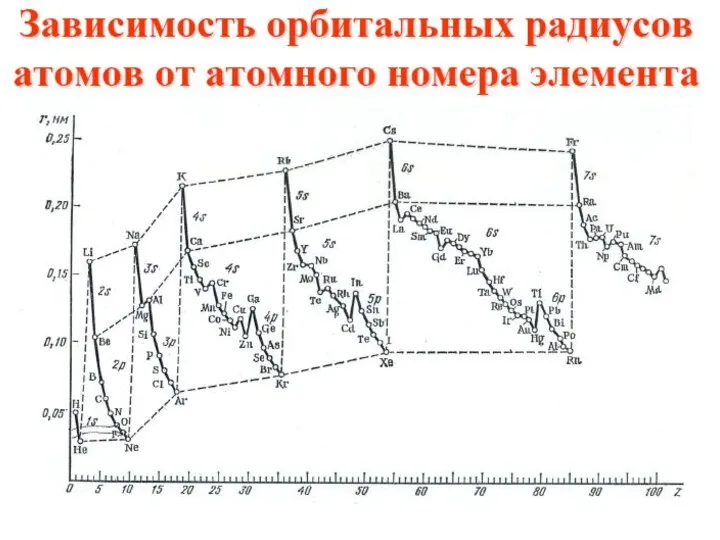
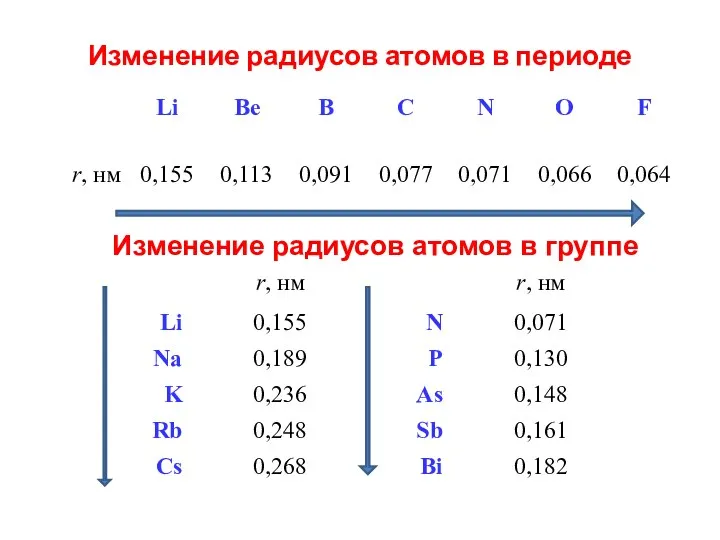
- 10. Изменение радиусов атомов в периоде Изменение радиусов атомов в группе
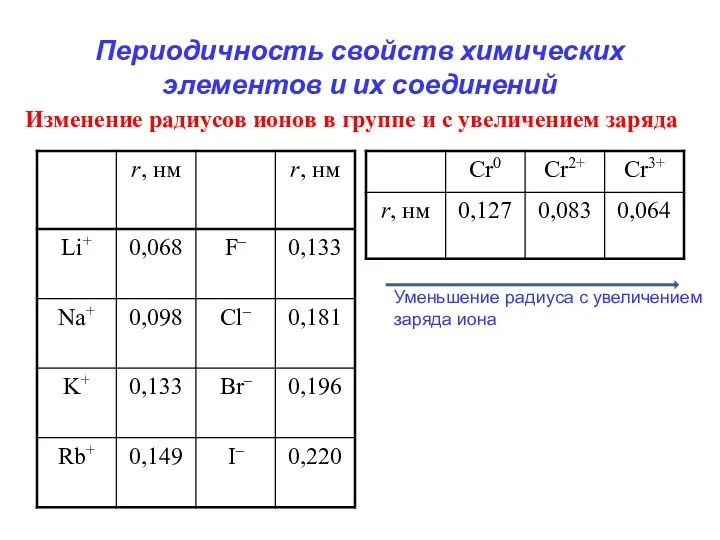
- 11. Периодичность свойств химических элементов и их соединений Изменение радиусов ионов в группе и с увеличением заряда
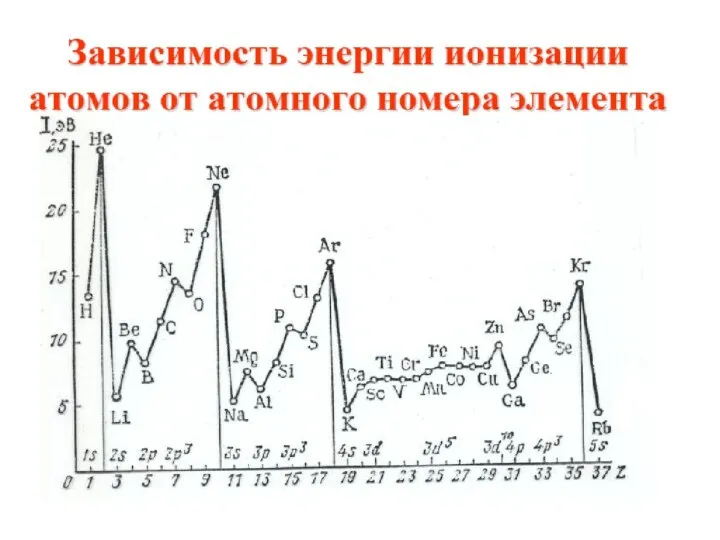
- 12. Энергией ионизации (первый потенциалом ионизации) I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома
- 13. В периодах слева направо заряд ядра возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается,
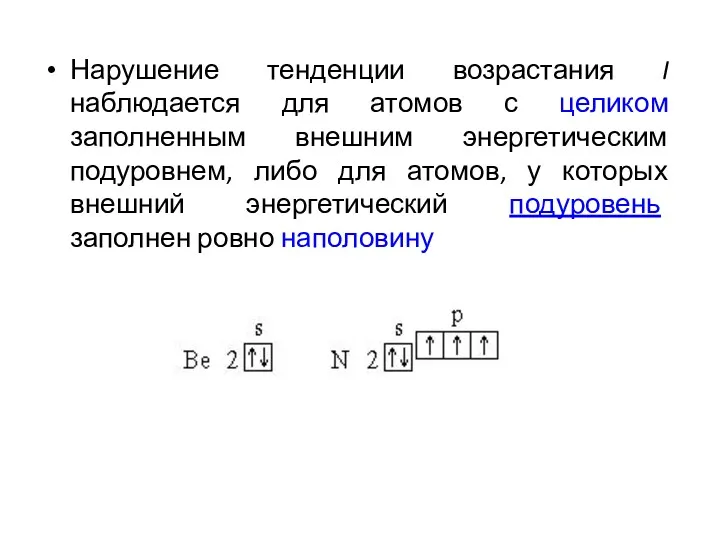
- 14. Нарушение тенденции возрастания I наблюдается для атомов с целиком заполненным внешним энергетическим подуровнем, либо для атомов,
- 16. Энергию отрыва электрона от отрицательного однозарядного иона в процессе X– – e = X0 называют сродством
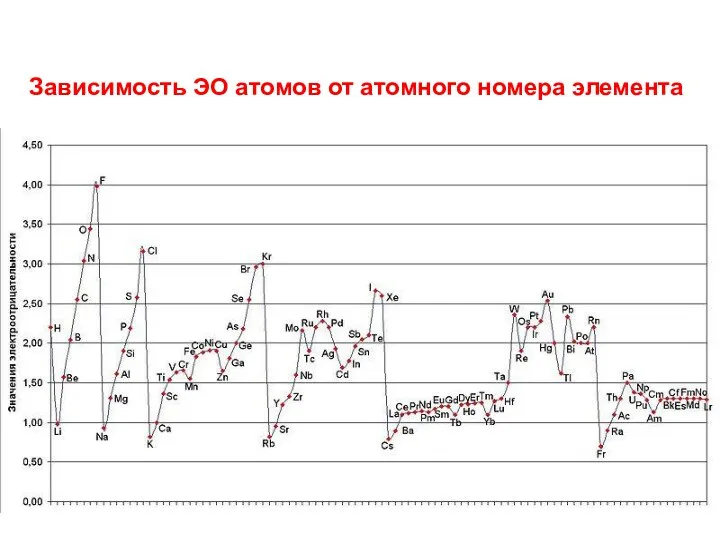
- 17. Зависимость ЭО атомов от атомного номера элемента
- 18. Окислительно-восстановительные свойства В периоде слева направо восста-новительные свойства ослабевают, т.к. потенциал ионизации возрастает. В подгруппах сверху
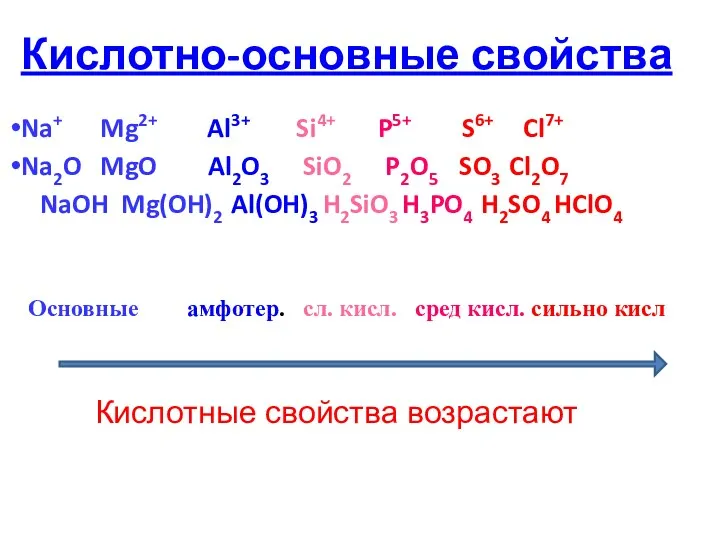
- 19. Кислотно-основные свойства Na+ Mg2+ Al3+ Si4+ P5+ S6+ Cl7+ Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
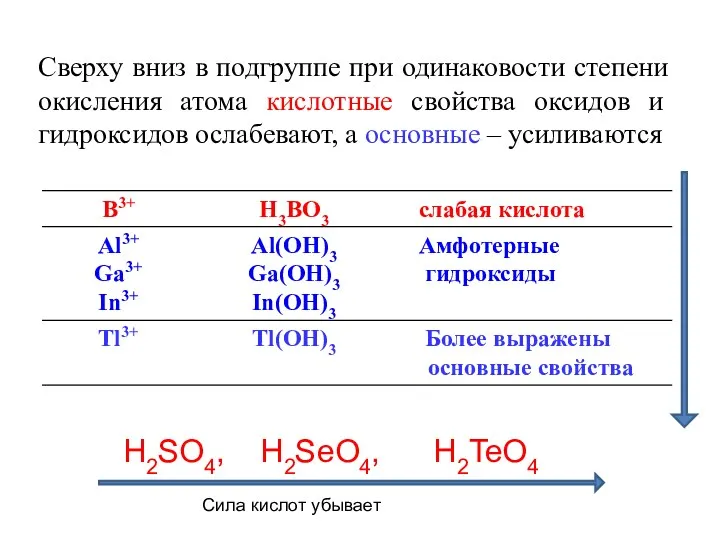
- 20. Сверху вниз в подгруппе при одинаковости степени окисления атома кислотные свойства оксидов и гидроксидов ослабевают, а
- 21. Химическая связь и строение молекул Принципы возникновения химической связи. Внутримолекулярные взаимодействия. Ионная связь. Ковалентная связь и
- 22. Общие положения Химическая связь - это взаимодействие атомов, обусловливающее устойчивость химической частицы или кристалла как целого.
- 23. 1861 г.- А.М. Бутлеров. Теория химического строения: 1) Атомы в молекуле соединены друг с другом в
- 24. Силы, объединяющие атомы в молекулы: 1. Электростатические взаимодействия: взаимодействия зарядов 2. Ковалентные взаимодействия: перераспределение электронной плотности
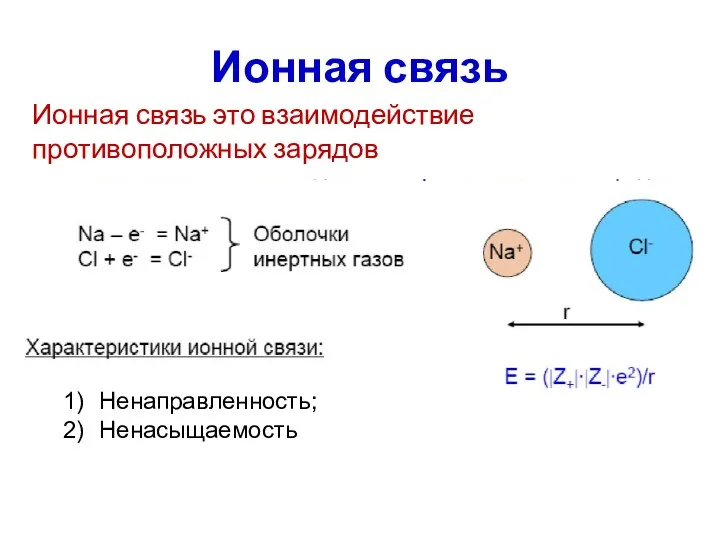
- 25. Ионная связь Ненаправленность; Ненасыщаемость Ионная связь это взаимодействие противоположных зарядов
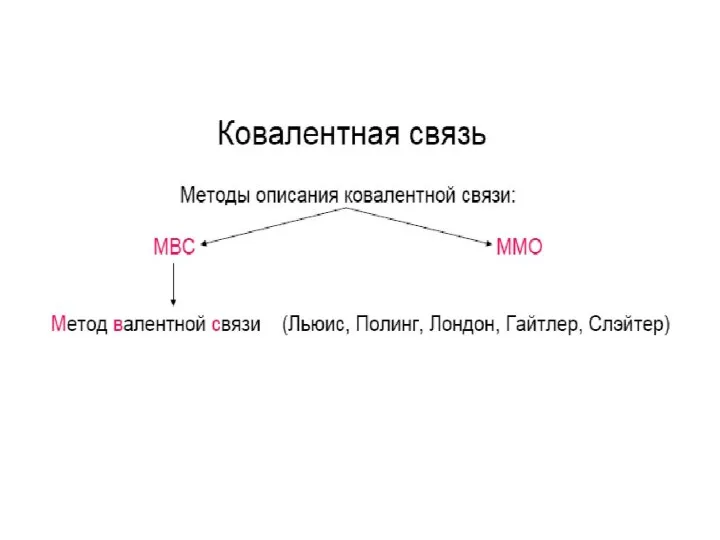
- 27. Метод валентных связей (МВС) иначе теория локализованных электронных пар. В основе лежит предположение, что химическая связь
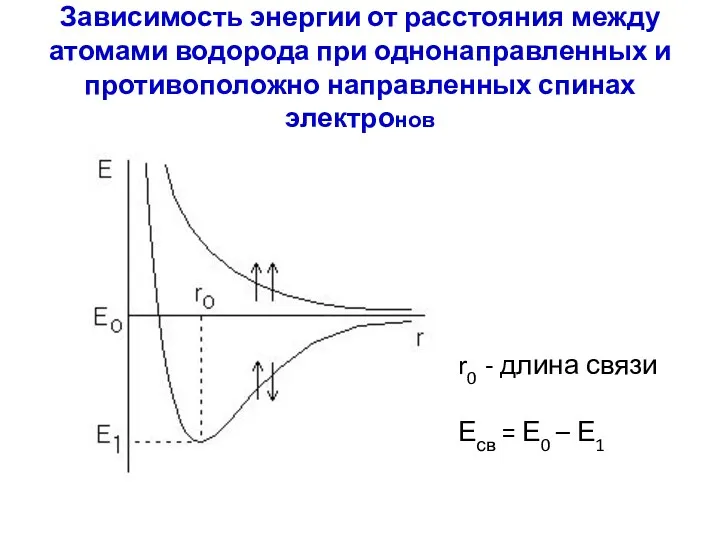
- 28. Зависимость энергии от расстояния между атомами водорода при однонаправленных и противоположно направленных спинах электронов r0 -
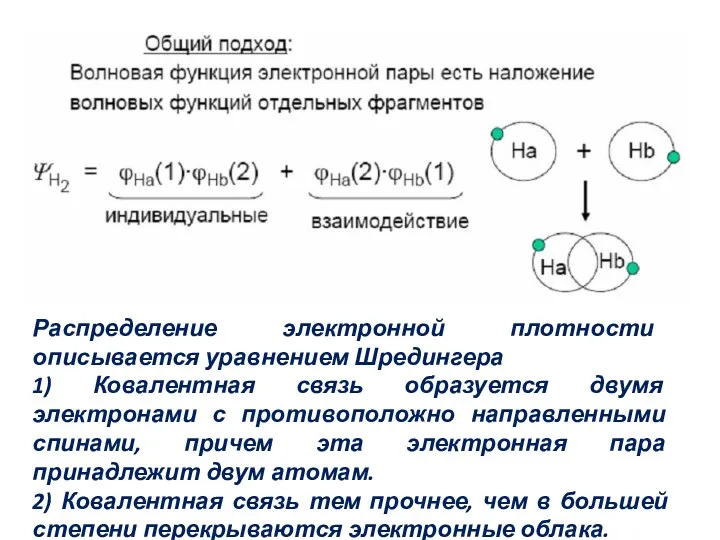
- 29. Распределение электронной плотности описывается уравнением Шредингера 1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами,
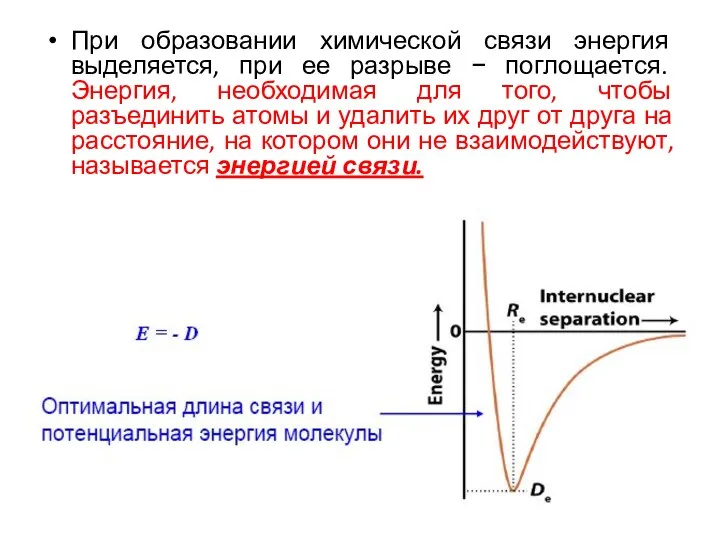
- 31. При образовании химической связи энергия выделяется, при ее разрыве − поглощается. Энергия, необходимая для того, чтобы
- 32. Длина связи определяется расстоянием между ядрами связанных атомов в молекуле. Как правило, длина химической связи меньше,
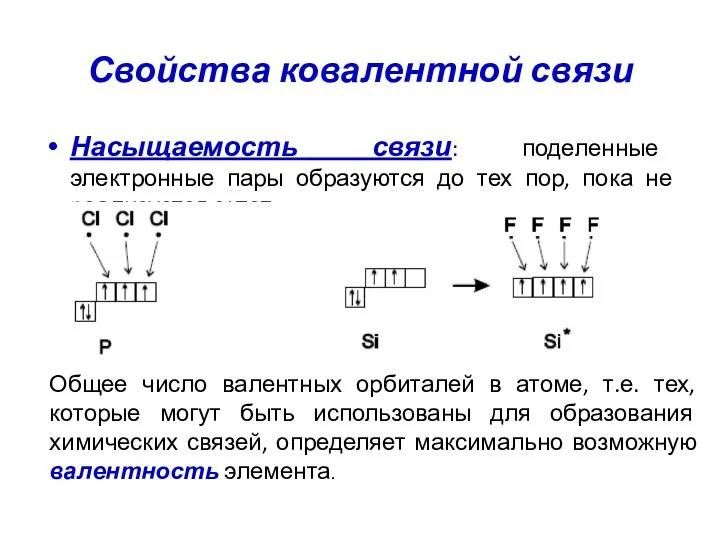
- 33. Свойства ковалентной связи Насыщаемость связи: поделенные электронные пары образуются до тех пор, пока не реализуется октет
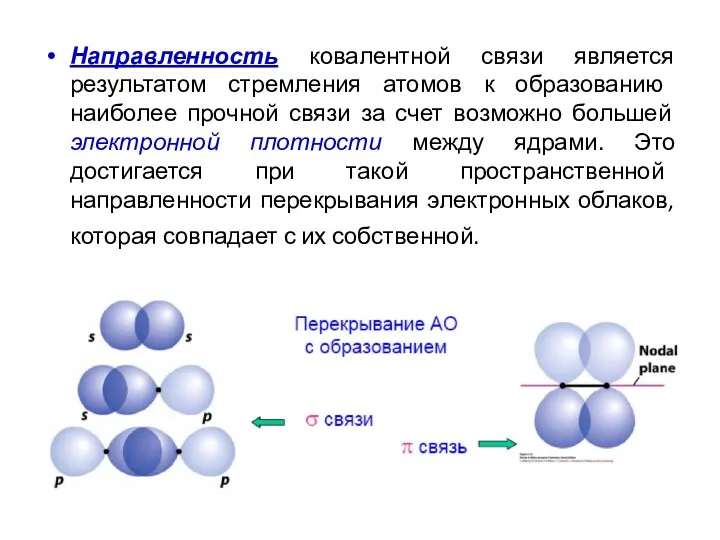
- 34. Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей
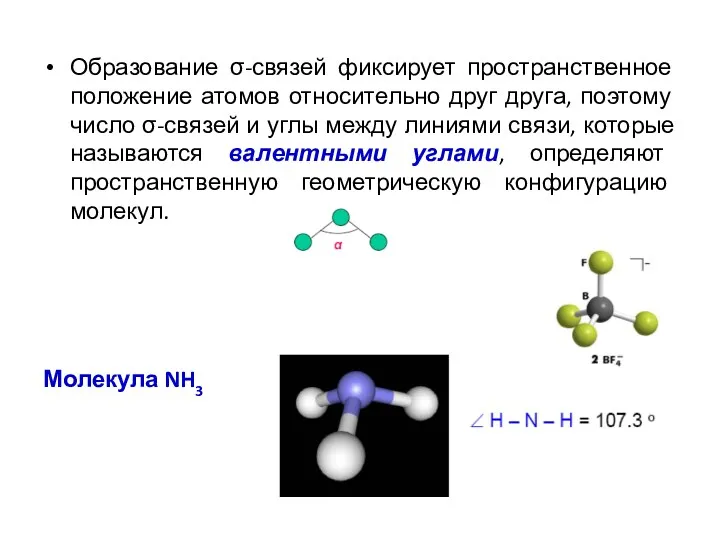
- 35. Образование σ-связей фиксирует пространственное положение атомов относительно друг друга, поэтому число σ-связей и углы между линиями
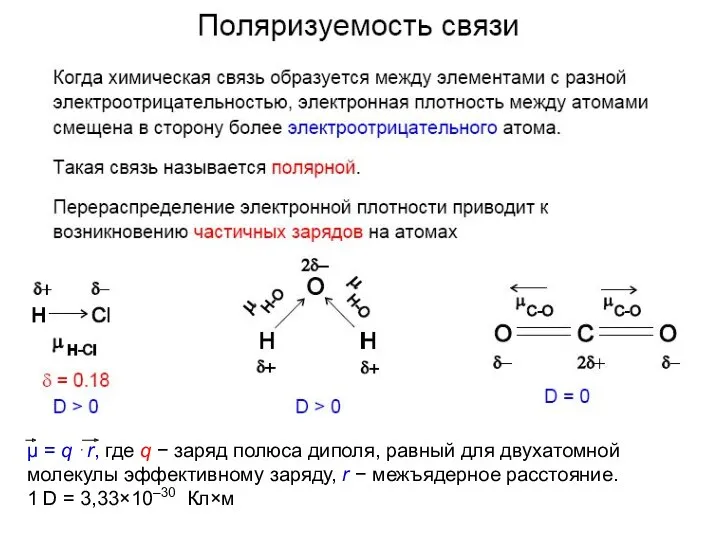
- 36. μ = q ⋅r, где q − заряд полюса диполя, равный для двухатомной молекулы эффективному заряду,
- 38. Скачать презентацию















 Аммиак
Аммиак Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева
Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева Комплексные соединения. Определения
Комплексные соединения. Определения Коррозия металлов
Коррозия металлов Классификация органических соединений
Классификация органических соединений Производство извести
Производство извести Добування кисню
Добування кисню Водород
Водород Строение атома (лекция 3)
Строение атома (лекция 3) Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Окислительно-восстановительные электроды
Окислительно-восстановительные электроды Алканы
Алканы Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Горение топлива
Горение топлива Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Алкины. Ацетилены
Алкины. Ацетилены Анализ анионов. Анализ смеси солей
Анализ анионов. Анализ смеси солей Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии Биофизическая химия. Предмет и задачи курса
Биофизическая химия. Предмет и задачи курса Химические реакции. Урок-обобщение
Химические реакции. Урок-обобщение Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Исследование снежного покрова
Исследование снежного покрова Алюминий и его соединения
Алюминий и его соединения Теоретические основы получения полимеров
Теоретические основы получения полимеров