Содержание
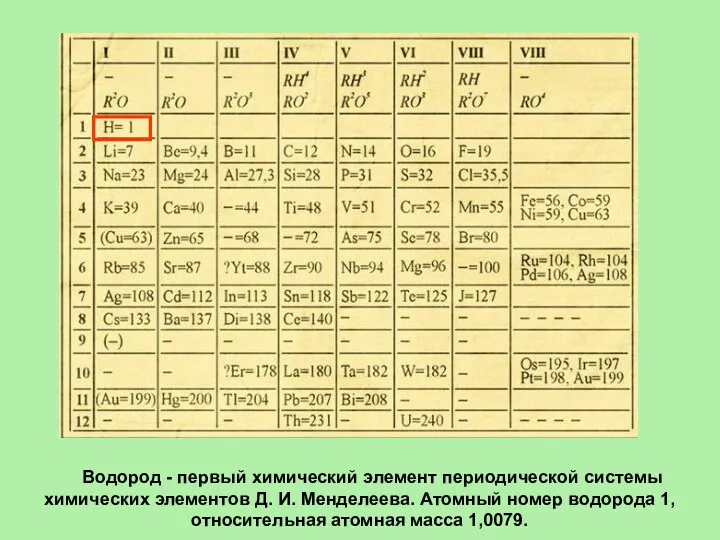
- 2. Водород - первый химический элемент периодической системы химических элементов Д. И. Менделеева. Атомный номер водорода 1,
- 3. Водород в природе Строение атома Физические свойства Получение Химические свойства Применение
- 4. Водород был открыт английским химиком Г. Кавендишем в 1766 г. Он относится к довольно распространенным элементам
- 5. Водород - самый распространенный элемент в космосе. Основная масса звезд состоит из водорода, он преимущественно составляет
- 6. Среди общего числа атомов, образующих Солнце, на водород приходится около 84%.
- 7. Водород входит в состав основного вещества Земли - воды.
- 8. Существуют два стабильных изотопа водорода - 1H (протий) и 2H (дейтерий), а также один радиоактивный -
- 9. При обычных условиях водород - газ без цвета и запаха, почти в 15 раз легче воздуха.
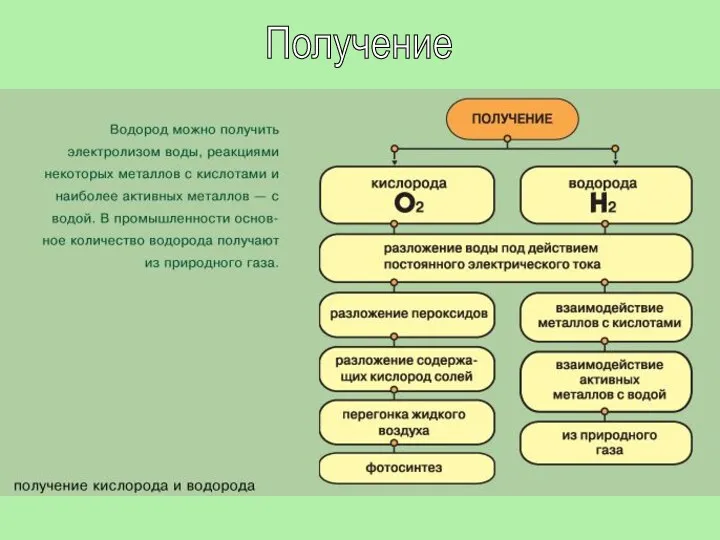
- 10. Получение
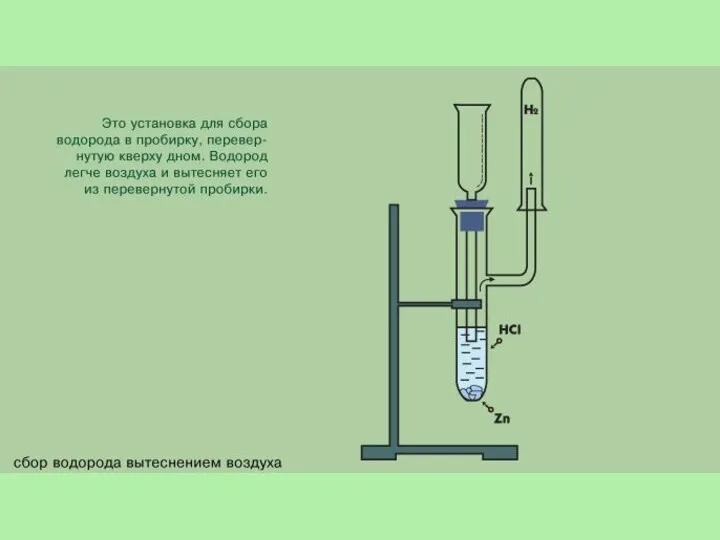
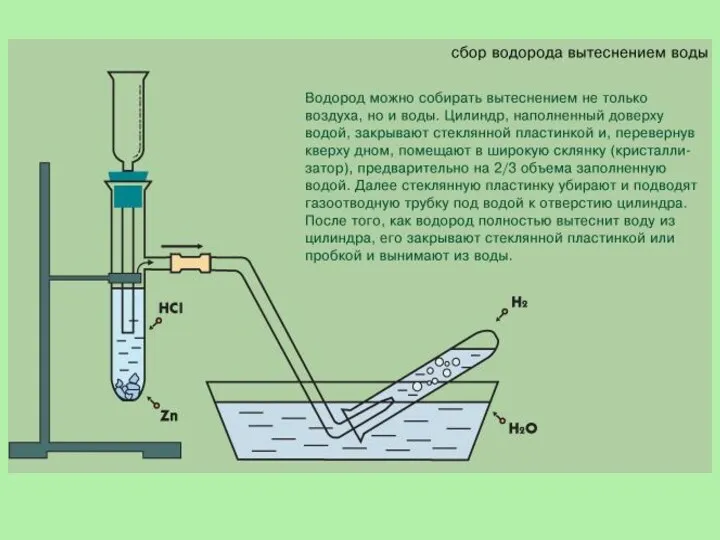
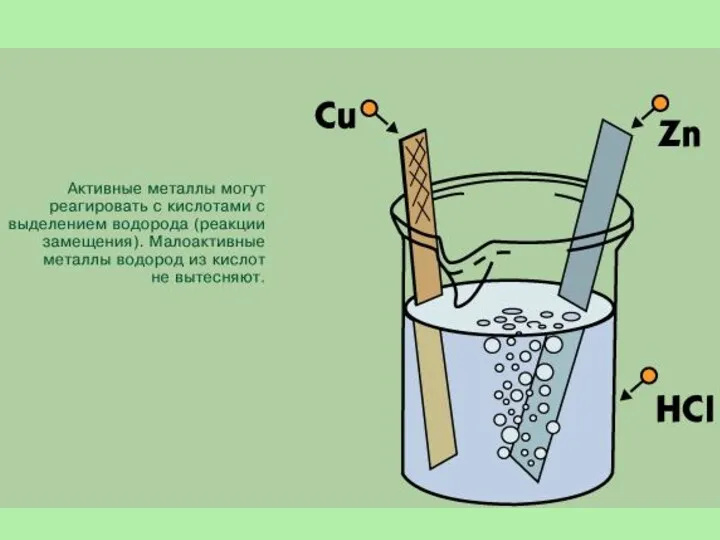
- 11. Получение водорода В лаборатории. 1. Действием на металлы (обычно цинк) соляной или разбавленной серной кислотой: Zn
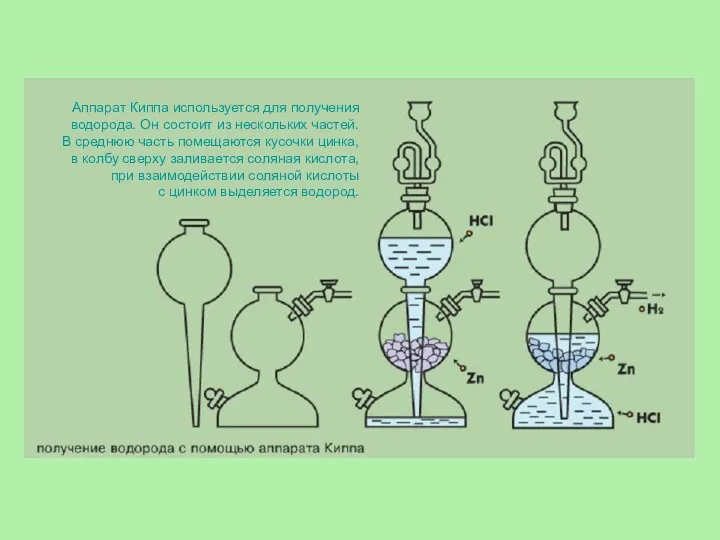
- 12. Аппарат Киппа используется для получения водорода. Он состоит из нескольких частей. В среднюю часть помещаются кусочки
- 18. Химические свойства
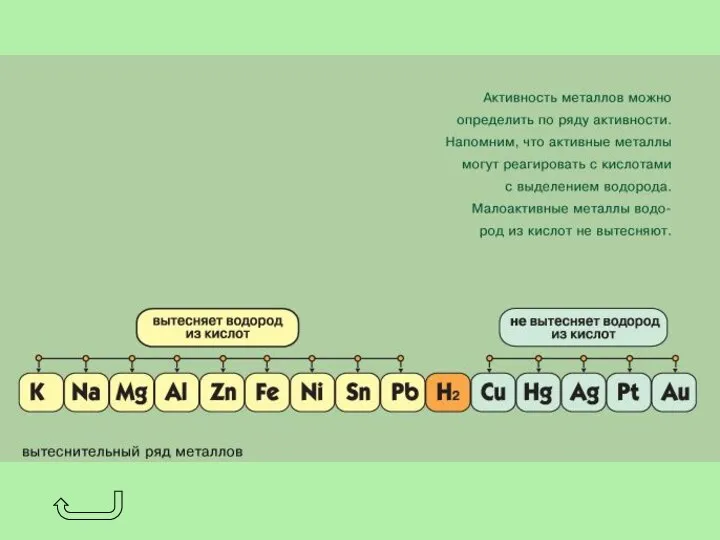
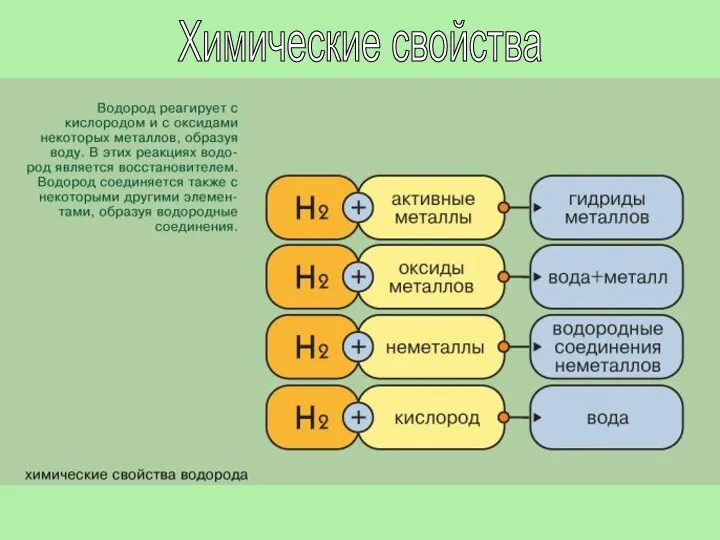
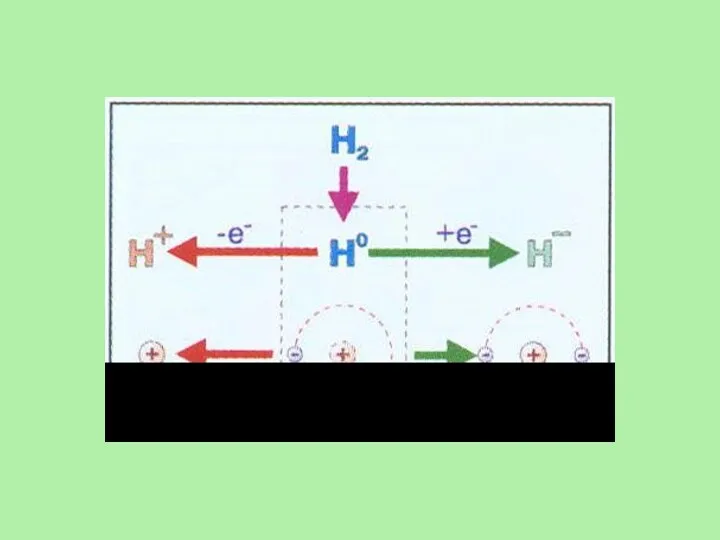
- 19. В соответствии со степенями окисления +1 и -1 в химических реакциях водород может быть окислителем или
- 22. В обычных условиях молекулярный водород взаимодействует лишь с наиболее активными элементами - со фтором взрывается в
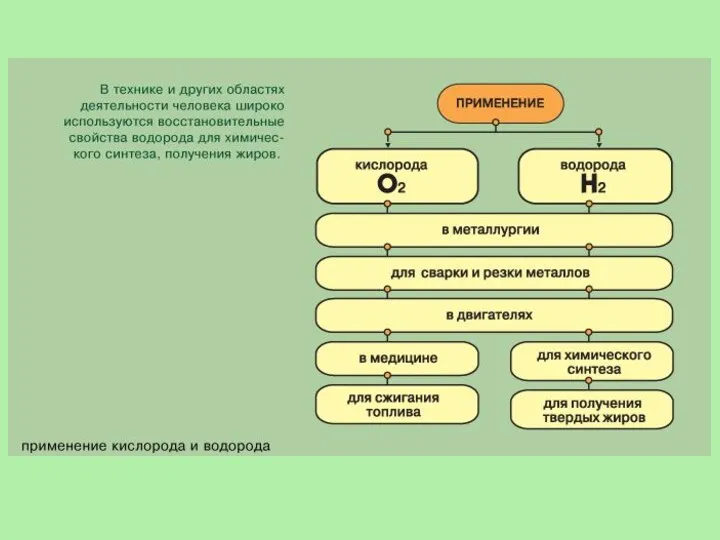
- 24. Водород используется для наполнения метеорологических зондов (ранее воздушных шаров и дирижаблей), как топливо в ракетной технике,
- 27. Скачать презентацию














 Запалювання нагрітим тілом та електричним розрядом
Запалювання нагрітим тілом та електричним розрядом Хімічні властивості кисню
Хімічні властивості кисню Легированные стали
Легированные стали Основы термодинамики
Основы термодинамики Химико-лесной комплекс
Химико-лесной комплекс Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Генетическая связь между классами веществ
Генетическая связь между классами веществ Алмаз. Алмаз дегеніміз не
Алмаз. Алмаз дегеніміз не Жуғыш заттардың адам өміріндегі маңызы. Химиялық өнімдердің адам өміріндері маңызы
Жуғыш заттардың адам өміріндегі маңызы. Химиялық өнімдердің адам өміріндері маңызы Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Строение атома. Лекция №2
Строение атома. Лекция №2 АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ.
АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ. Простые вещества — металлы и неметаллы
Простые вещества — металлы и неметаллы Растворы
Растворы Спирты. Действие этанола на организм человека (10 класс)
Спирты. Действие этанола на организм человека (10 класс) Чистые вещества и смеси
Чистые вещества и смеси Химические реакции. Типы химических реакций
Химические реакции. Типы химических реакций Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері
Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері №2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу
№2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу Подготовка к ВПР по химии. 8 класс
Подготовка к ВПР по химии. 8 класс Углерод
Углерод Химия и производство
Химия и производство Строение атома углерода
Строение атома углерода Ионная химическая связь
Ионная химическая связь Активизация познавательной деятельности учащихся на уроках химии
Активизация познавательной деятельности учащихся на уроках химии Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер
Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер Коррозия каменных и бетонных строительных конструкций
Коррозия каменных и бетонных строительных конструкций Кремний и его соединения
Кремний и его соединения