Содержание
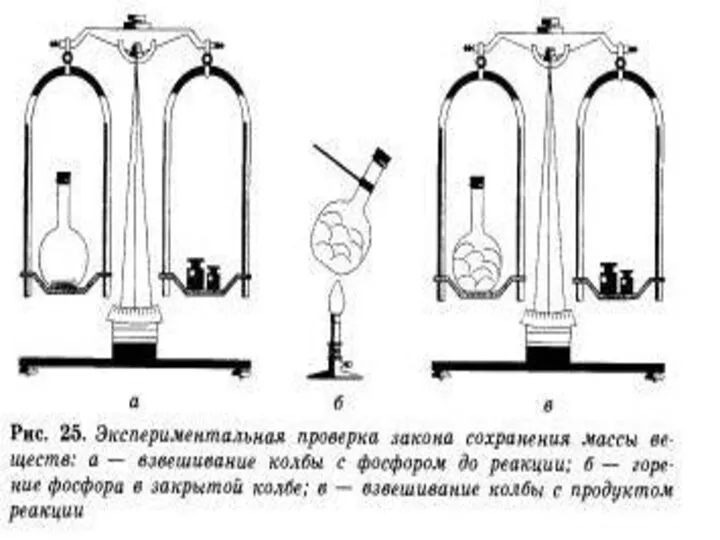
- 2. М.В.Ломоносов в 1748 г. впервые сформулировал и экспериментально доказал закон сохранения массы веществ
- 4. Формулировка закона: Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
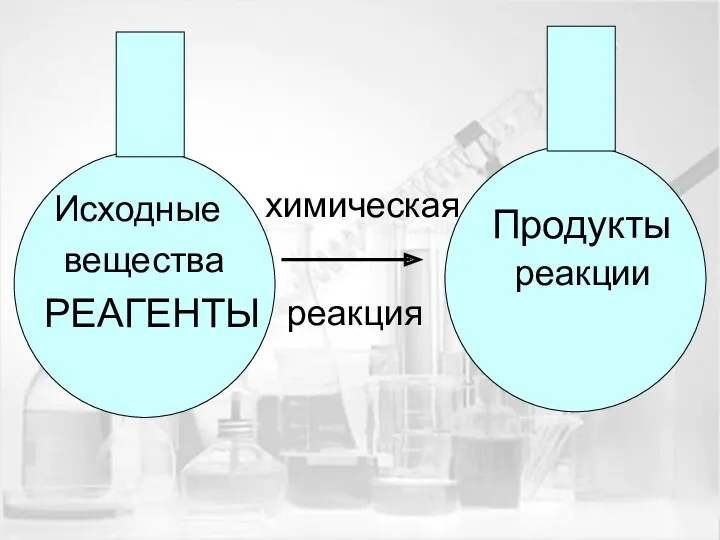
- 5. Исходные вещества РЕАГЕНТЫ химическая реакция Продукты реакции
- 6. Атомы не появляются и не исчезают при химической реакции
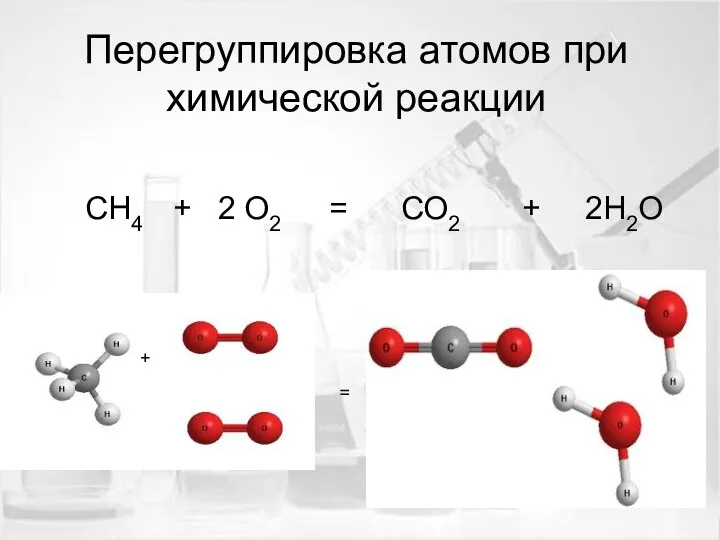
- 7. Перегруппировка атомов при химической реакции СН4 + 2 О2 = СО2 + 2Н2О + =
- 8. Правила составления химических уравнений 1. В левой части уравнения записать формулы реагентов. Затем поставить стрелку. а)
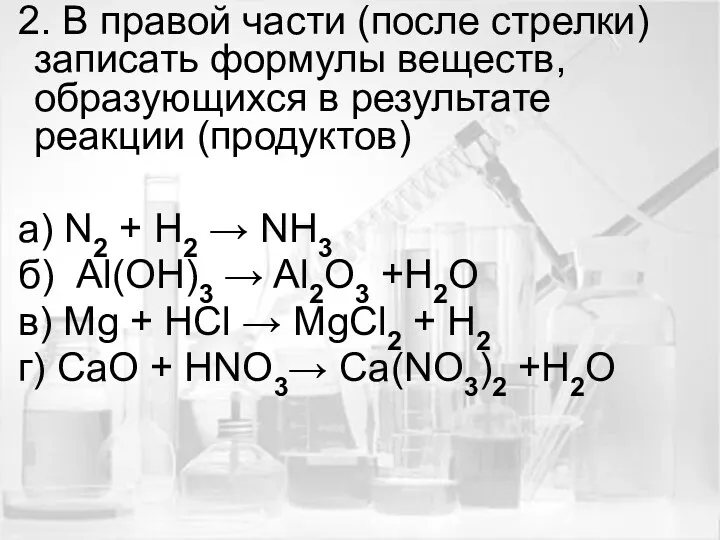
- 9. 2. В правой части (после стрелки) записать формулы веществ, образующихся в результате реакции (продуктов) а) N2
- 10. 3. Уравнение реакции составляется на основе закона сохранения массы веществ, т. е. слева и справа должно
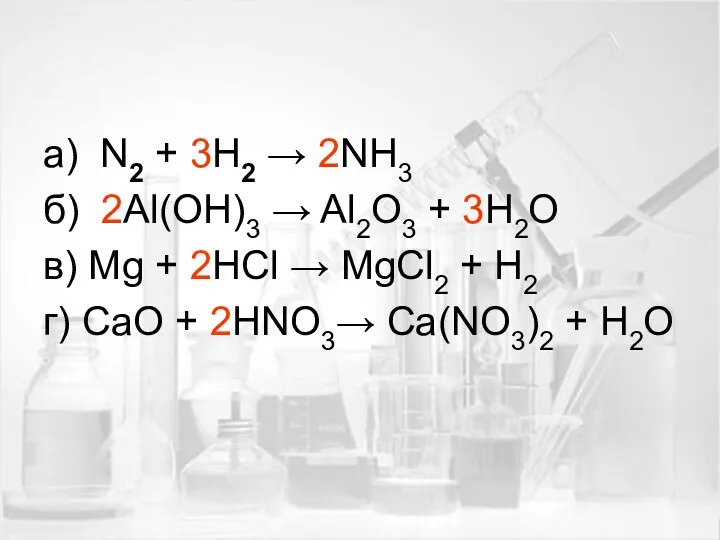
- 11. а) N2 + 3H2 → 2NH3 б) 2Al(OH)3 → Al2O3 + 3H2O в) Mg + 2HCl
- 12. Новые вещества не получаются из ничего и не могут обратиться в ничто. При химических реакциях происходит
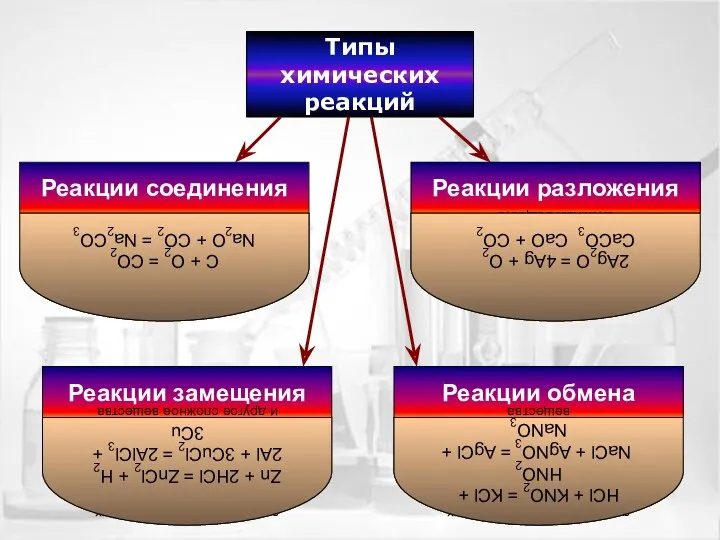
- 13. Типы химических реакций Реакции обмена Реакции соединения Реакции разложения Реакции замещения это реакции, в ходе которых
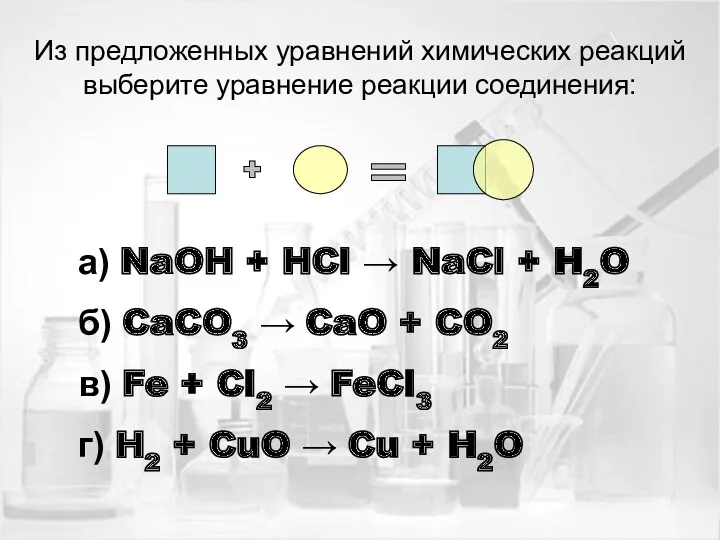
- 14. Из предложенных уравнений химических реакций выберите уравнение реакции соединения: а) NaOH + HCl → NaCl +
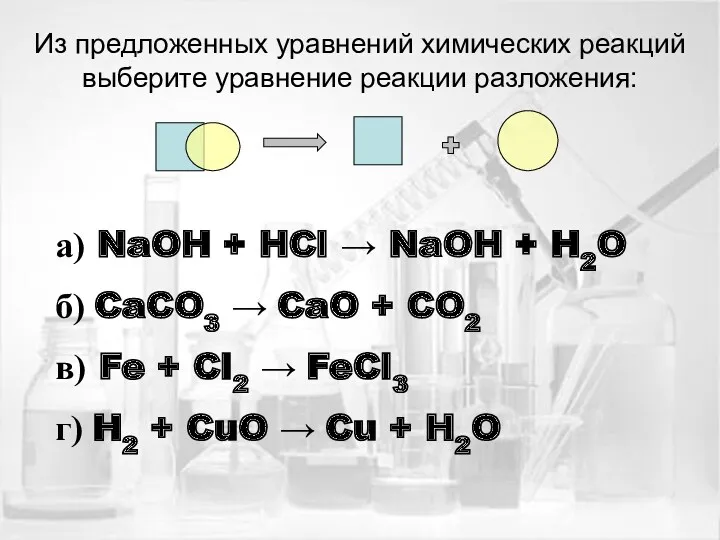
- 15. Из предложенных уравнений химических реакций выберите уравнение реакции разложения: а) NaOH + HCl → NaOH +
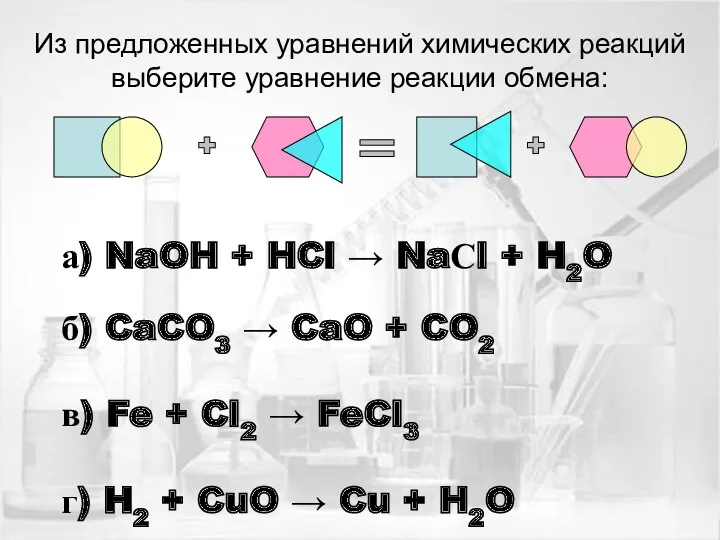
- 16. Из предложенных уравнений химических реакций выберите уравнение реакции обмена: а) NaOH + HCl → NaСl +
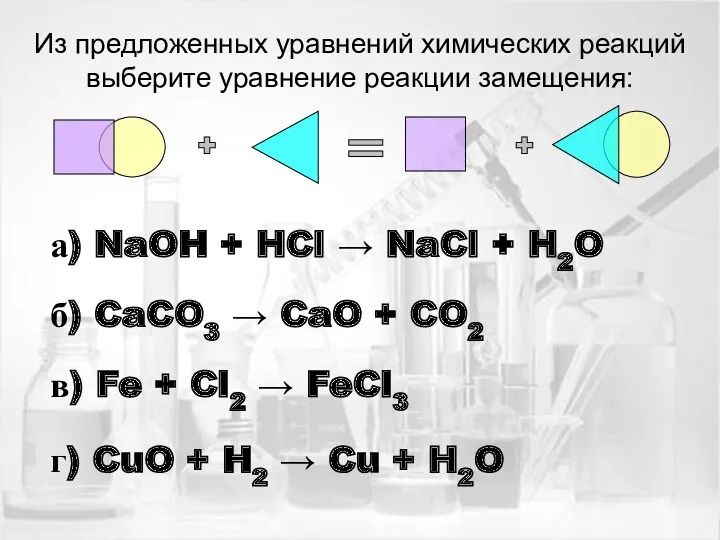
- 17. Из предложенных уравнений химических реакций выберите уравнение реакции замещения: а) NaOH + HCl → NaCl +
- 18. Расставьте коэффициенты, преобразовав схемы в уравнения реакций 1) Ca + S ? CaS 2) Al +
- 20. Расставьте коэффициенты, преобразовав схемы в уравнения реакций 1) Fe2O3 + H2 ? H2O + Fe 2)
- 22. Скачать презентацию









 Фазовые равновесия. Физическая и коллоидная химия
Фазовые равновесия. Физическая и коллоидная химия
 Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Получение и распознавание водорода
Получение и распознавание водорода Альдольные реакции енолятов
Альдольные реакции енолятов Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Вода – это жизнь!
Вода – это жизнь! Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды)
Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды) Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Металлические сплавы
Металлические сплавы Химическая кинетика
Химическая кинетика Ненасыщенные (непредельные) алифатические углеводороды. Алкены
Ненасыщенные (непредельные) алифатические углеводороды. Алкены Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Равновесия в растворах электролитов
Равновесия в растворах электролитов Электроотрицательность. Степень окисления. Валентность
Электроотрицательность. Степень окисления. Валентность Первичная переработка нефти
Первичная переработка нефти Оксиды. Названия оксидов
Оксиды. Названия оксидов Свойства смесей ПАВ
Свойства смесей ПАВ Типы химических реакций
Типы химических реакций Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Химическая кинетика. Раздел 2
Химическая кинетика. Раздел 2 Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот
Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот Основы общей химии. Тема 1
Основы общей химии. Тема 1 Водно-химический режим ТЭС. Основные задачи, организация и виды ВХР. Предотвращение коррозии, борьба с отложениями
Водно-химический режим ТЭС. Основные задачи, организация и виды ВХР. Предотвращение коррозии, борьба с отложениями Олово и свинец
Олово и свинец