Содержание
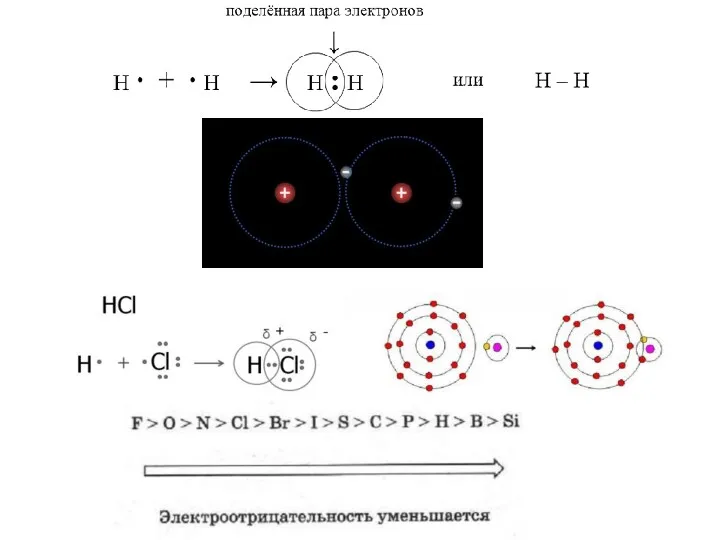
- 2. ЭО – сила (кто сильнее, тот и забирает) ЭО – способность атомов в молекуле смещать к
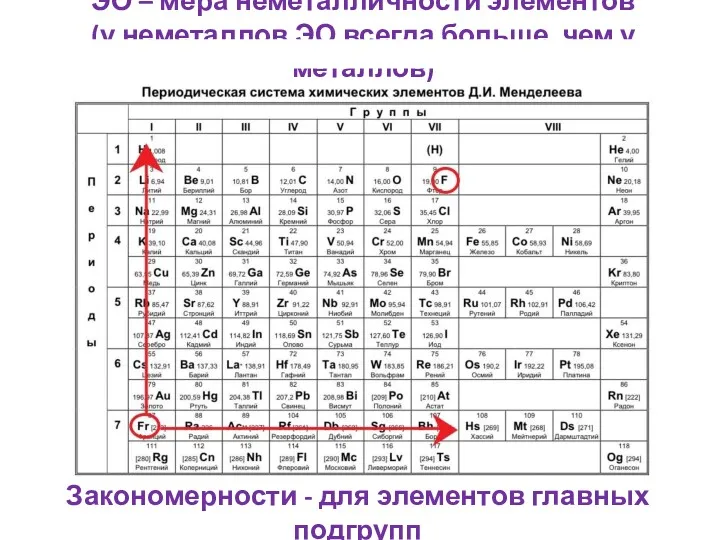
- 4. ЭО – мера неметалличности элементов (у неметаллов ЭО всегда больше, чем у металлов) Закономерности - для
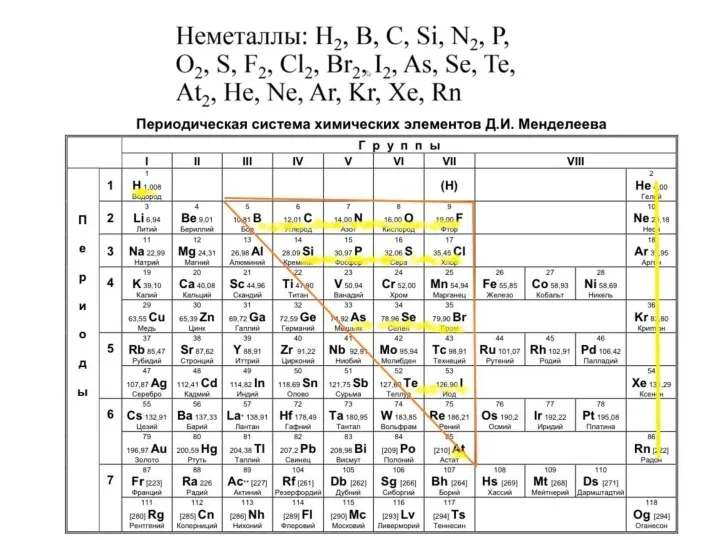
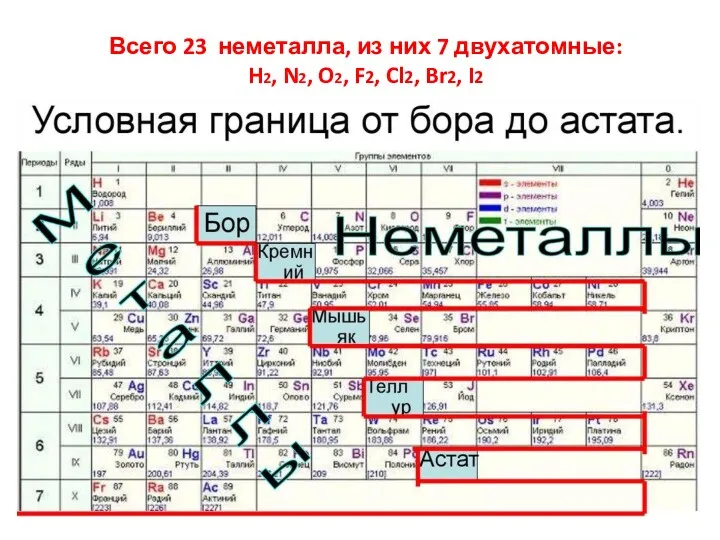
- 6. Всего 23 неметалла, из них 7 двухатомные: H2, N2, O2, F2, Cl2, Br2, I2
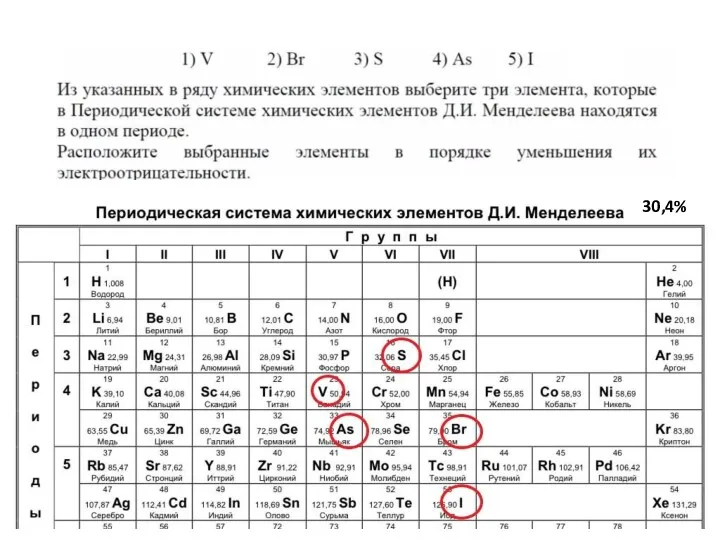
- 7. 30,4%
- 8. F O N Лидеры по ЭО
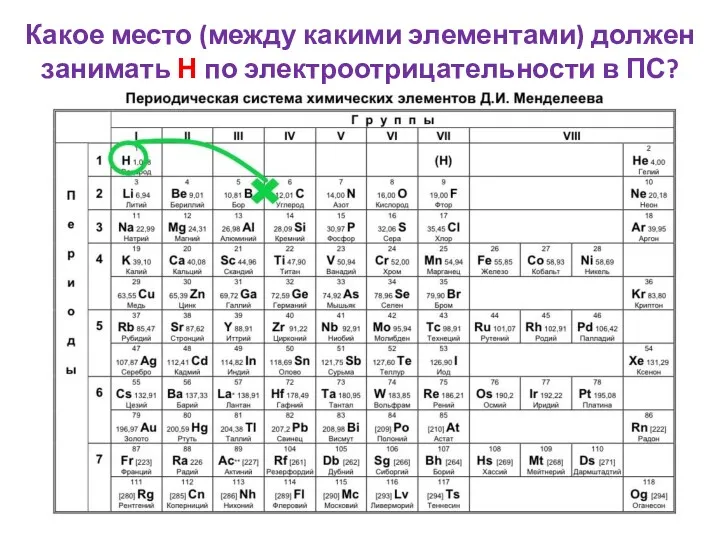
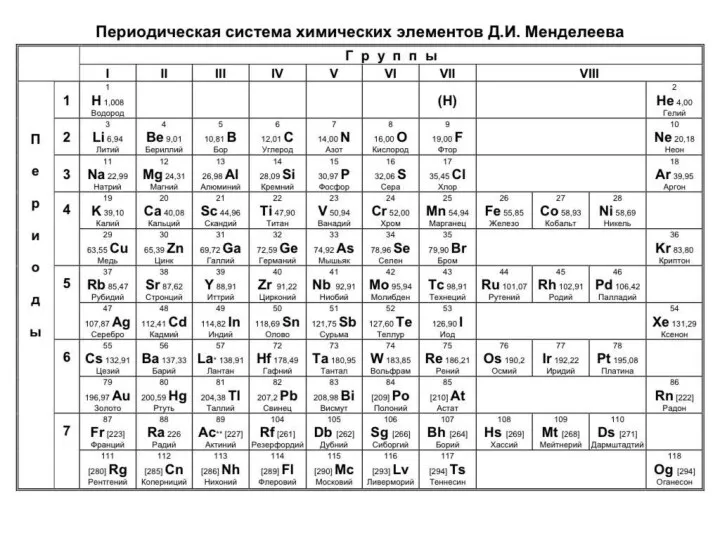
- 9. Какое место (между какими элементами) должен занимать Н по электроотрицательности в ПС?
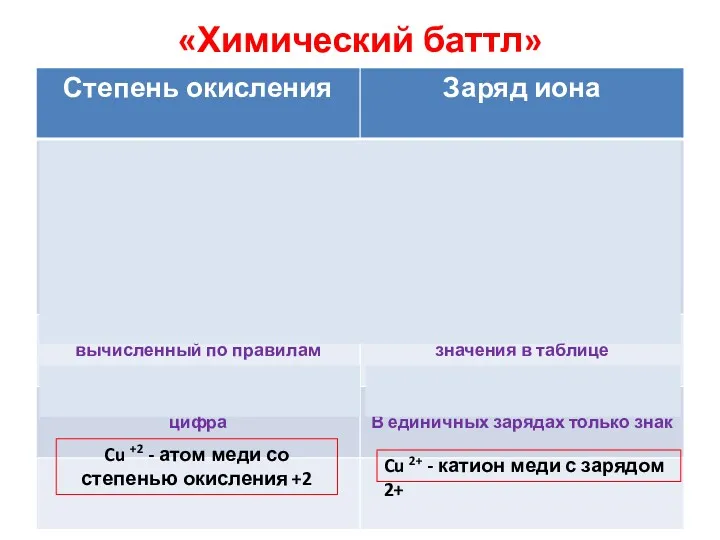
- 10. «Химический баттл» Cu 2+ - катион меди с зарядом 2+ Cu +2 - атом меди со
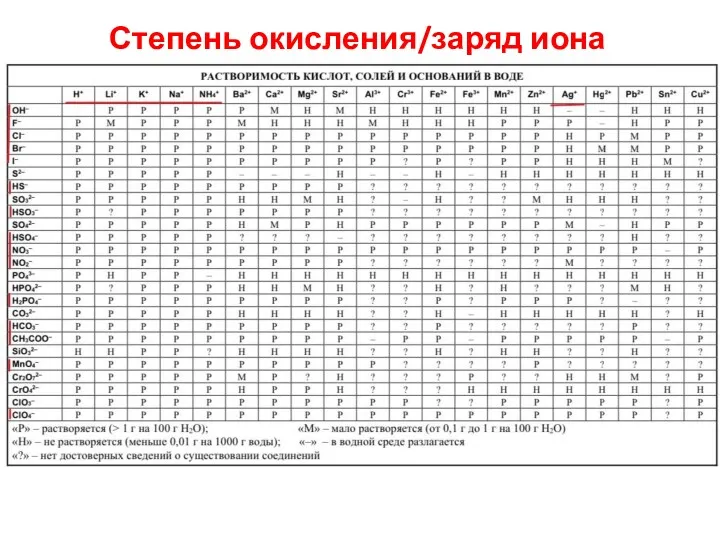
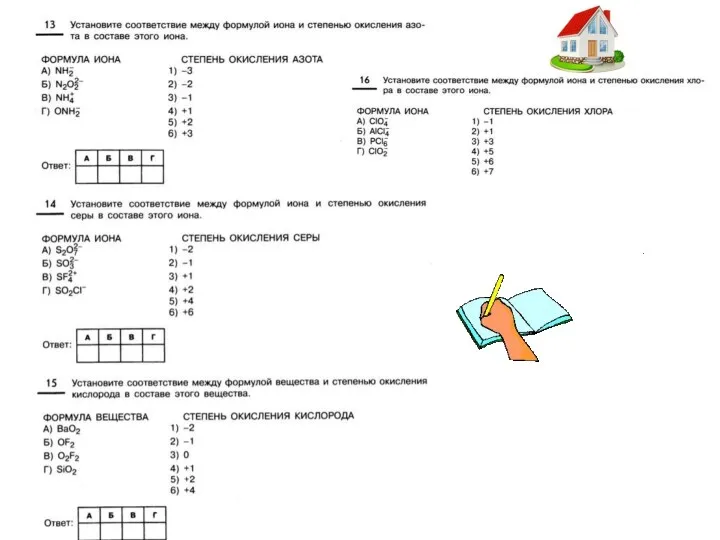
- 11. Степень окисления/заряд иона
- 12. Чем ограничены? Правила определения степени окисления У металлов низшая степень окисления всегда равна нулю, всегда положительная
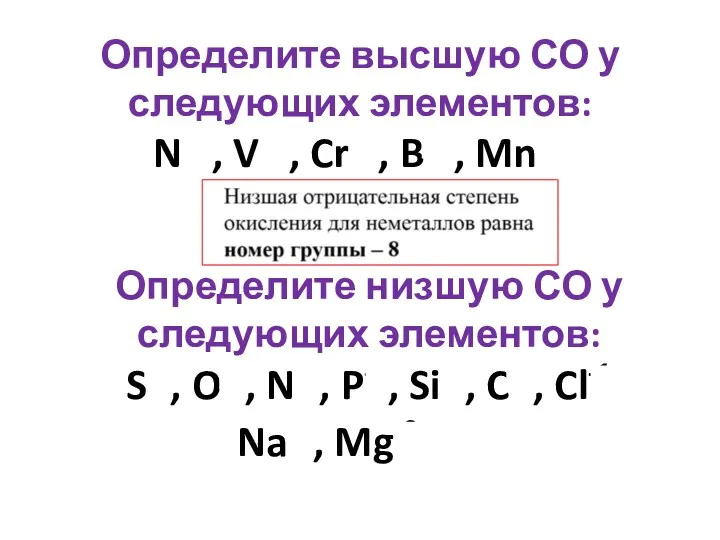
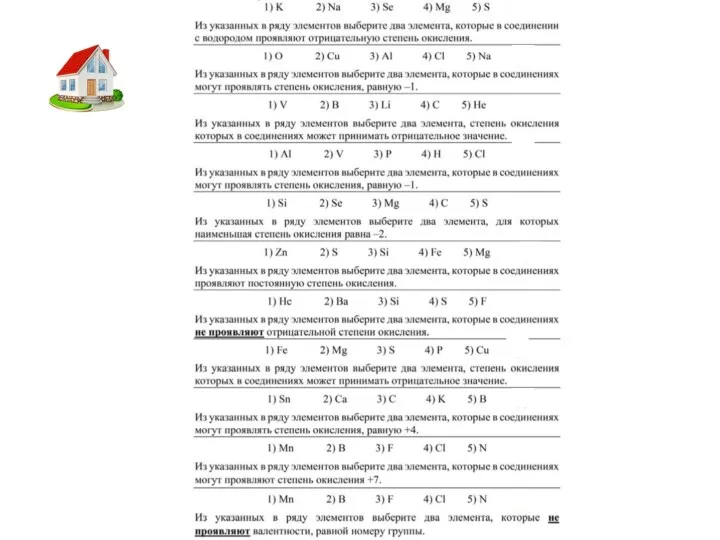
- 15. Определите высшую СО у следующих элементов: N+5, V+5, Cr+6, B+3, Mn+7 Определите низшую СО у следующих
- 17. Определить СО NaF, AlCl3, NaCl, BaO2, Al4C3, Al2(SO4)3, H2SO4, SCl2, NH4F, LiAlH4, KBrO3, K2MnO4, HClO, SO32-,
- 19. В порядке уменьшения: В порядке увеличения: от большего к меньшему от меньшего к большему
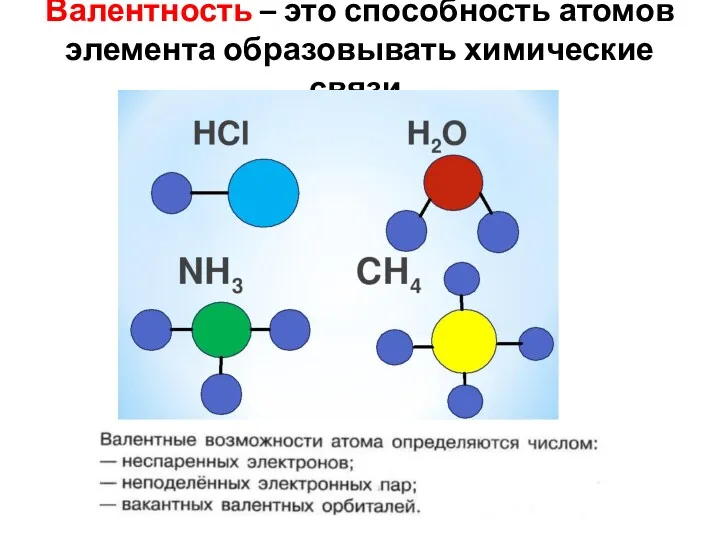
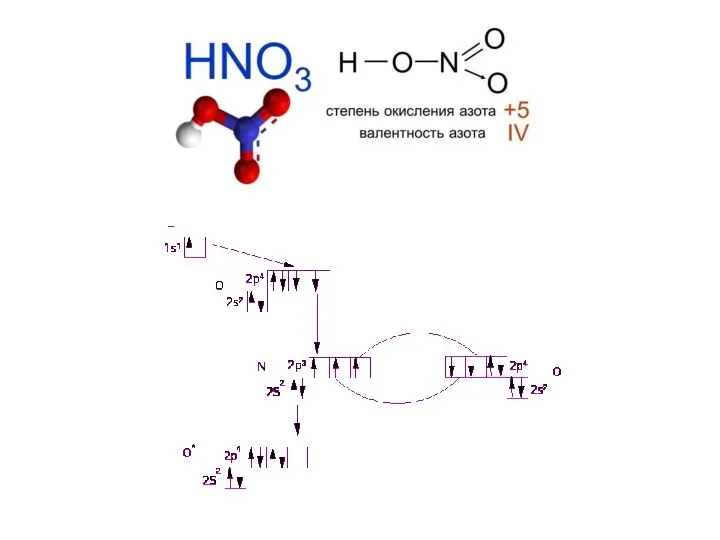
- 20. Валентность – это способность атомов элемента образовывать химические связи.
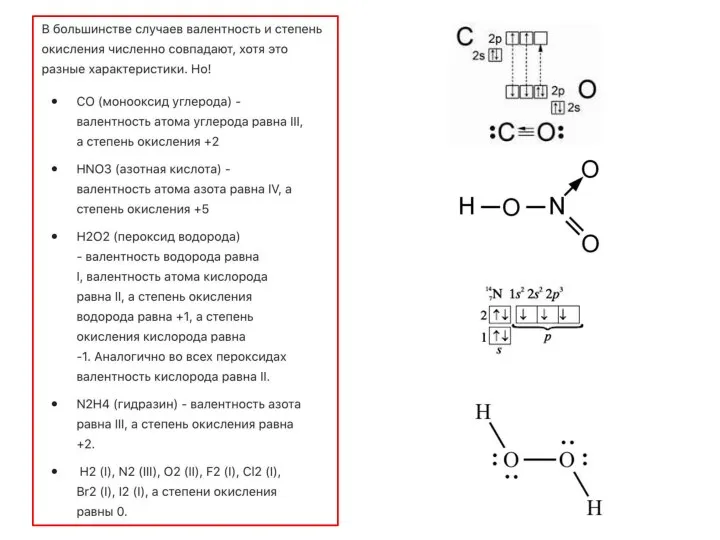
- 21. Не имеет знака Не всегда совпадает со степенью окисления (соединения с ковалентной связью)
- 24. Валентность С в органических соединениях IV Степень окисления первичного атома углерода минус три, вторичного минус два,
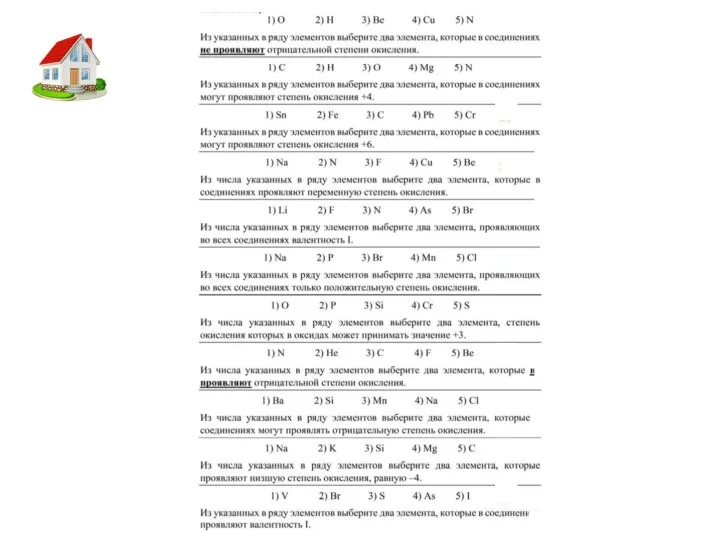
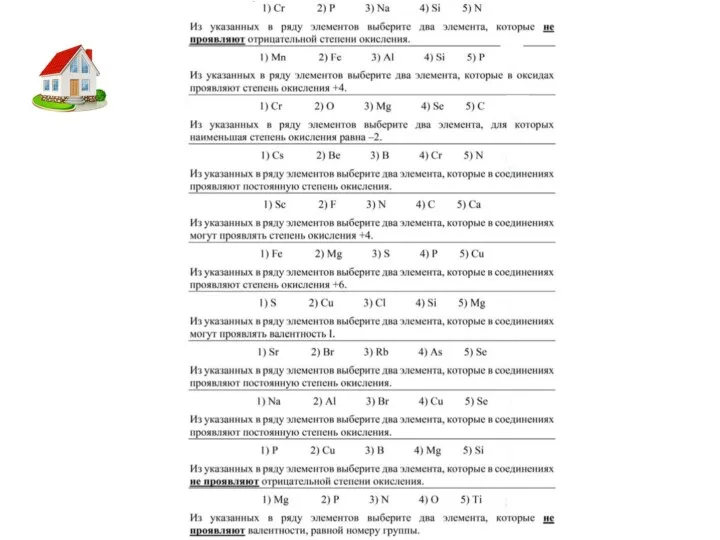
- 25. Какие из элементов второго периода не проявляют высшей валентности равной номеру группы? Какие из элементов второго
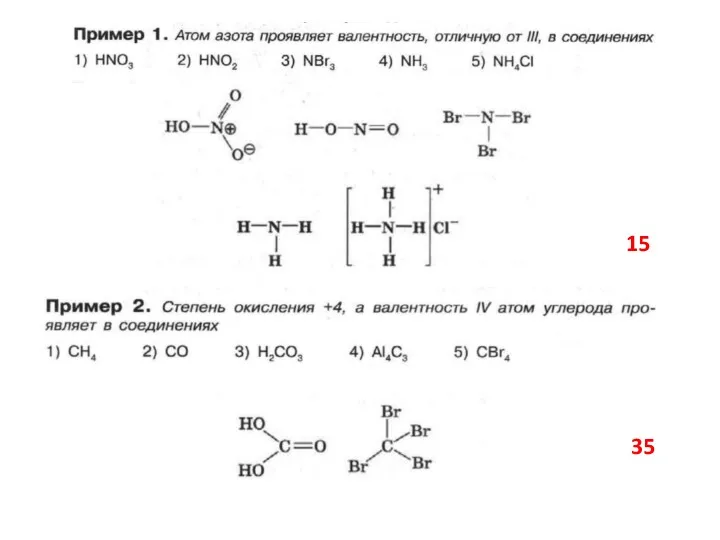
- 26. 15 35
- 27. 35 25 235
- 42. 25 45
- 44. Скачать презентацию























 Горение взрывчатых веществ
Горение взрывчатых веществ Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях Калій. Знаходження в періодичній системі і основні характеристики
Калій. Знаходження в періодичній системі і основні характеристики Практическая работа №2. Наблюдение за горящей свечой
Практическая работа №2. Наблюдение за горящей свечой Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Нефть и нефтеподукты
Нефть и нефтеподукты Минеральные вещества
Минеральные вещества Распространенные названия некоторых неорганических веществ
Распространенные названия некоторых неорганических веществ Оксиды. 9 класс
Оксиды. 9 класс Химические формулы веществ (8 класс)
Химические формулы веществ (8 класс) Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Электронное строение элементов-органогенов. Типы химической связи
Электронное строение элементов-органогенов. Типы химической связи Предмет, история и задачи геохимии, положение среди других наук
Предмет, история и задачи геохимии, положение среди других наук Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Ионная связь
Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Ионная связь Минералы и их строение
Минералы и их строение Окислительно-восстановительные реакции. (лекция №10)
Окислительно-восстановительные реакции. (лекция №10) Химическая кинетика
Химическая кинетика Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан Производство серной кислоты
Производство серной кислоты Фолий қышқылы (B9 дәрумені)
Фолий қышқылы (B9 дәрумені) Классификация веществ в зависимости от типа химической связи
Классификация веществ в зависимости от типа химической связи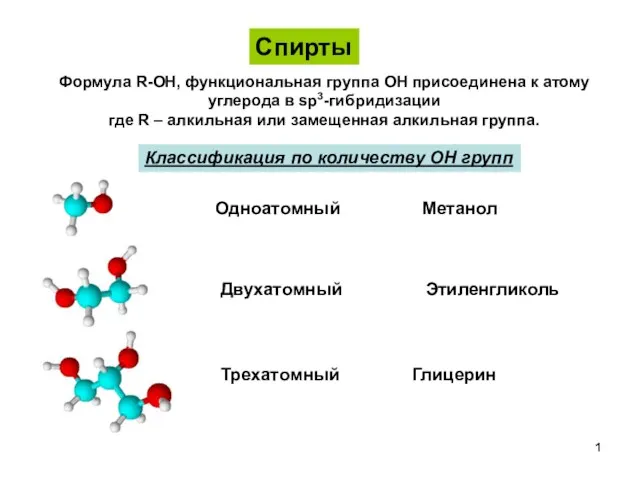 Спирты, фенолы, простые эфиры
Спирты, фенолы, простые эфиры Классификация опасных грузов
Классификация опасных грузов Кислород. Характеристика и применение
Кислород. Характеристика и применение Природный газ
Природный газ Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений
Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений Минералогия литофильных редких элементов. Барий и стронций
Минералогия литофильных редких элементов. Барий и стронций IV группа главная подгруппа
IV группа главная подгруппа