Содержание
- 2. Из кого получится больше кислорода всех по 5г: HgO, KMnO4, H2O2? Проверка ДЗ
- 3. Ещё один способ получения кислорода в лаборатории, проходит в присутствии катализатора. Разложение бертоллетовой соли: 2KClO3 ----->
- 4. В промышленности кислород получают из … Получение в промышленности
- 5. В промышленности кислород получают из воздуха. Для получения кислорода воздух под давлением сжижают. Так как, температура
- 6. Свойства Физические Химические Свойства
- 7. Физические свойства кислорода Бесцветный газ, без вкуса и запаха. Плохо растворим в воде (на 100 объёмов
- 8. При нагревании кислород энергично реагирует со многими веществами. При таких реакциях выделяется энергия в виде света
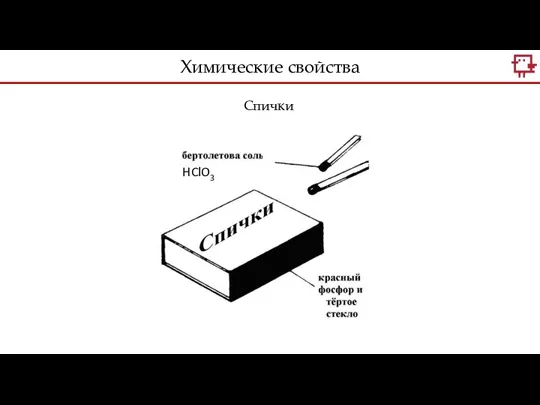
- 9. Спички Химические свойства HClO3
- 10. Хенниг Бранд Первые фосфорные спички – Шарль Сория, 1831 г. Они были с Р4 (белым фосфором)
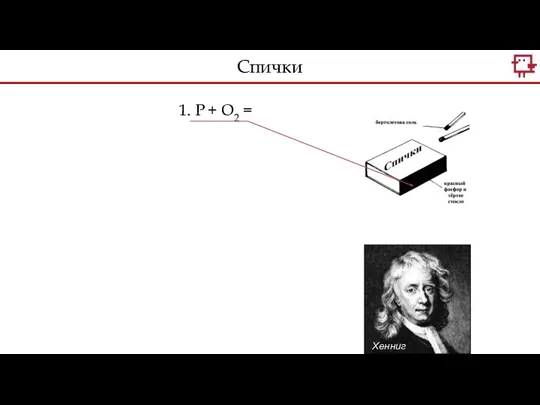
- 11. Хенниг Бранд 1. P + O2 = Спички
- 12. Хенниг Бранд 4P + 5O2 = P2O5 KClO3 = Спички
- 14. Скачать презентацию








 Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Минералы и горные породы
Минералы и горные породы Осадительное титрование. Меркуриметрия
Осадительное титрование. Меркуриметрия Способы получения металлов
Способы получения металлов Вуглеводи
Вуглеводи Соли. 8 класс
Соли. 8 класс General characteristics of halogens. Halogen compounds
General characteristics of halogens. Halogen compounds Все о чае
Все о чае Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Вещества
Вещества Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Электролиз. Электролизеры
Электролиз. Электролизеры Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Первичная структура белков и пептидов
Первичная структура белков и пептидов Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Углерод
Углерод Химический элемент и формы его существования
Химический элемент и формы его существования Век пластмасс
Век пластмасс Синтетический каучук и его применение
Синтетический каучук и его применение 20231009_zhyostkost_vody
20231009_zhyostkost_vody Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Платина. Физические и химические свойства
Платина. Физические и химические свойства Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії
Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії Алюминий и его соединения
Алюминий и его соединения Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Каучук. Открытие каучука
Каучук. Открытие каучука