Содержание
- 2. Аминокислотный состав и аминокислотная последовательность Понятие о различных уровнях структурной организации пептидов и белков ввел Кай
- 3. Определение аминокислотного состава 25.02.2013 Первичная структура белков и пептидов. Лекция
- 4. Анализ аминокислотного состава включает полный кислотный гидролиз исследуемого белка или пептида с помощью 5,7н HCl и
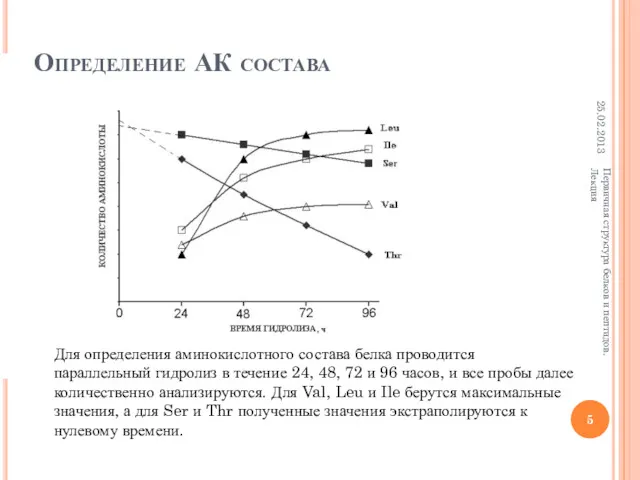
- 5. Определение АК состава Для определения аминокислотного состава белка проводится параллельный гидролиз в течение 24, 48, 72
- 6. Количественное определение аминокислот в гидролизате белка или пептида проводится с помощью аминокислотного анализатора - прибора, разработанного
- 7. Аминокислотная последовательность - это порядок чередования аминокислотных остатков в молекуле пептида или белка. Аминокислотная последовательность составляет
- 8. Критерии чистоты белковых препаратов аналитическое ультрацентрифугирование; электрофорез в нативных или денатурирующих условиях; иммунохимические методы; определение N-
- 9. Определение N- и С- концевого аминокислотного остатка 25.02.2013 Первичная структура белков и пептидов. Лекция
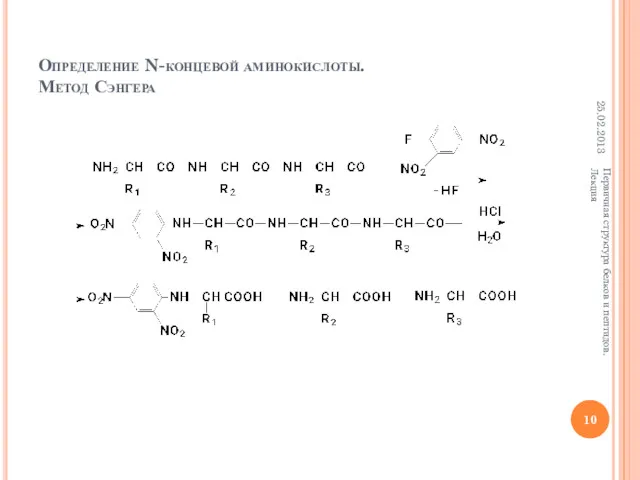
- 10. Определение N-концевой аминокислоты. Метод Сэнгера 25.02.2013 Первичная структура белков и пептидов. Лекция
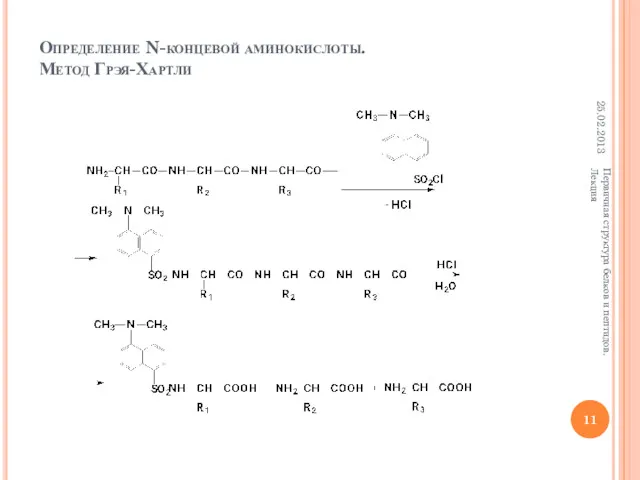
- 11. Определение N-концевой аминокислоты. Метод Грэя-Хартли 25.02.2013 Первичная структура белков и пептидов. Лекция
- 12. Высокоэффективная двумерная тонкослойная хроматография 25.02.2013 Первичная структура белков и пептидов. Лекция В условиях жесткого кислотного гидролиза
- 13. Определение С-концевой аминокислоты Гидразинолиз 25.02.2013 Первичная структура белков и пептидов. Лекция Метод предложен Акабори в 1952
- 14. Определение С-концевой аминокислоты с помощью карбоксипептидаз (энзиматический гидролиз) Карбоксипептидаза А - отщепляет аминокислоты с ароматической и
- 15. Определение аминокислотной последовательности 25.02.2013 Первичная структура белков и пептидов. Лекция
- 16. Определение аминокислотной (N-концевой)последовательности белков с помощью метода Эдмана 25.02.2013 Первичная структура белков и пептидов. Лекция Основным
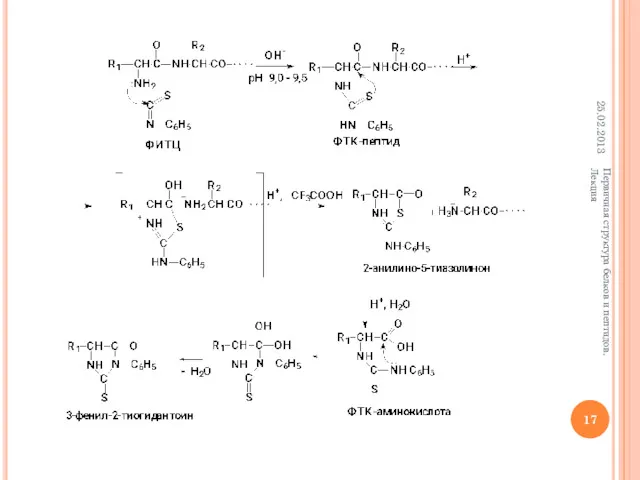
- 17. 25.02.2013 Первичная структура белков и пептидов. Лекция
- 18. Метод Эдмана-Грея В 1972 г. В.Греем было предложено использовать метод Эдмана в сочетании с реакцией дансилирования
- 19. Автоматическое секвенирование 25.02.2013 Первичная структура белков и пептидов. Лекция После кислотной обработки N-концевая АК отщепляется и
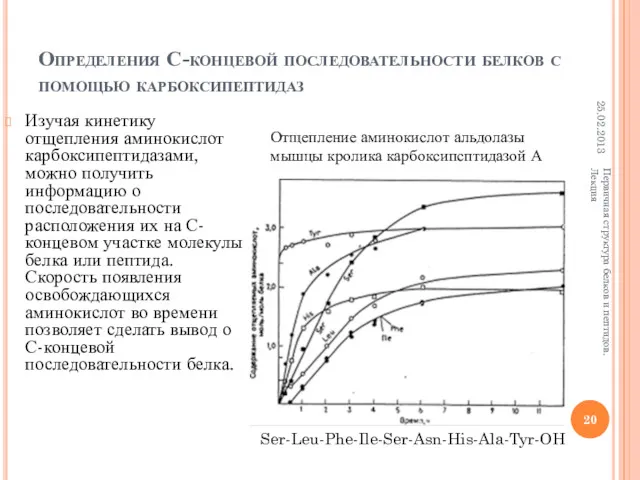
- 20. Определения С-концевой последовательности белков с помощью карбоксипептидаз Изучая кинетику отщепления аминокислот карбоксипептидазами, можно получить информацию о
- 21. 25.02.2013 Первичная структура белков и пептидов. Лекция При работе с карбоксипептидазами необходимо учитывать следующие основные проблемы:
- 22. Определение АК последовательности методом «перекрывающихся блоков» Определение АК состава, N- и С-концевых АК (при необходимости) Восстановление
- 23. 25.02.2013 Первичная структура белков и пептидов. Лекция 4. Селективное расщепление пептидных связей -1 4.1. Разделение смеси,
- 24. определении аминокислотной последовательности пептидов масс-спектрометрическим методом Используется способность ионизированных молекул пептидов распадаться по так называемому аминокислотному
- 25. Сиквенс deNovo 25.02.2013 Первичная структура белков и пептидов. Лекция
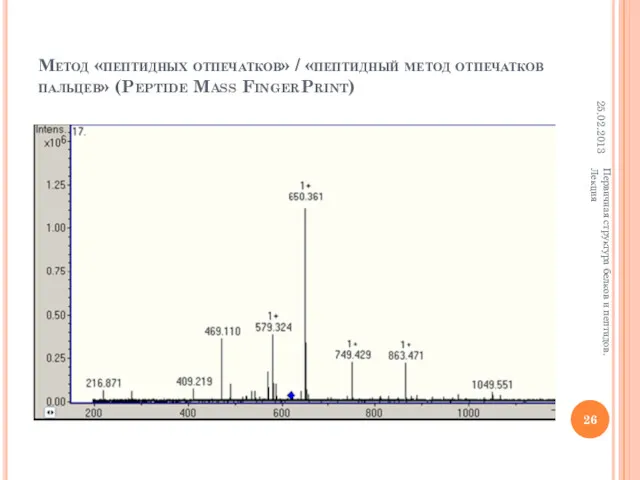
- 26. Метод «пептидных отпечатков» / «пептидный метод отпечатков пальцев» (Peptide Mass FingerPrint) 25.02.2013 Первичная структура белков и
- 27. Установление АК последовательности белка на основе нуклеотидной последовательности кодирующего его гена Развитие методов анализа последовательности ДНК
- 28. Белки Определение белков. Классификация и свойства белков. 25.02.2013 Первичная структура белков и пептидов. Лекция
- 29. 25.02.2013 Первичная структура белков и пептидов. Лекция Белки – это полипептиды, способные самопроизвольно формировать и сохранять
- 30. классификация белков 25.02.2013 Первичная структура белков и пептидов. Лекция Альбумины (хорошо растворяются в воде. Содержатся в
- 31. классификация белков 25.02.2013 Первичная структура белков и пептидов. Лекция Глобулярные белки́ — белки, в молекулах которых
- 33. Скачать презентацию
























 Дисперсные системы
Дисперсные системы Происхождение нефти
Происхождение нефти Періодичний закон. Хімія. 8 клас
Періодичний закон. Хімія. 8 клас Дендример, или арборол
Дендример, или арборол Сплавы и коррозия металлов
Сплавы и коррозия металлов An introduction to the chemistry of alkenes
An introduction to the chemistry of alkenes Сложные эфиры
Сложные эфиры Исследование процесса диффузии на примере движения частиц в жидкостях и газах
Исследование процесса диффузии на примере движения частиц в жидкостях и газах Определение расхода воздуха на горение, количество и температуру продуктов
Определение расхода воздуха на горение, количество и температуру продуктов Электролиз раствора щёлочи с использованием железного анода
Электролиз раствора щёлочи с использованием железного анода Озон. Применение
Озон. Применение Кристаллические и аморфные тела
Кристаллические и аморфные тела Понятия о металлических сплавах. Лекция 4
Понятия о металлических сплавах. Лекция 4 Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Подгруппа азота
Подгруппа азота Конструкционные материалы. Пластмассы
Конструкционные материалы. Пластмассы Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Водород. Свойства водорода
Водород. Свойства водорода Спирты. Определение. Классификация
Спирты. Определение. Классификация Химический элемент вольфрам
Химический элемент вольфрам Чипсы: вред или польза
Чипсы: вред или польза Газоподібна і тверда фаза грунту. Методи аналізу зернового складу
Газоподібна і тверда фаза грунту. Методи аналізу зернового складу Пластмаси. Властивості пластмас. Склад пластичних мас. Види пластмаси
Пластмаси. Властивості пластмас. Склад пластичних мас. Види пластмаси Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты
Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты Синтез нуклеотидов
Синтез нуклеотидов Чистые вещества и смеси
Чистые вещества и смеси 20231110_amfoternye_oksidy_i_gidroksidy
20231110_amfoternye_oksidy_i_gidroksidy Формирование системы знаний о веществе. Лекция 14-15
Формирование системы знаний о веществе. Лекция 14-15