Содержание
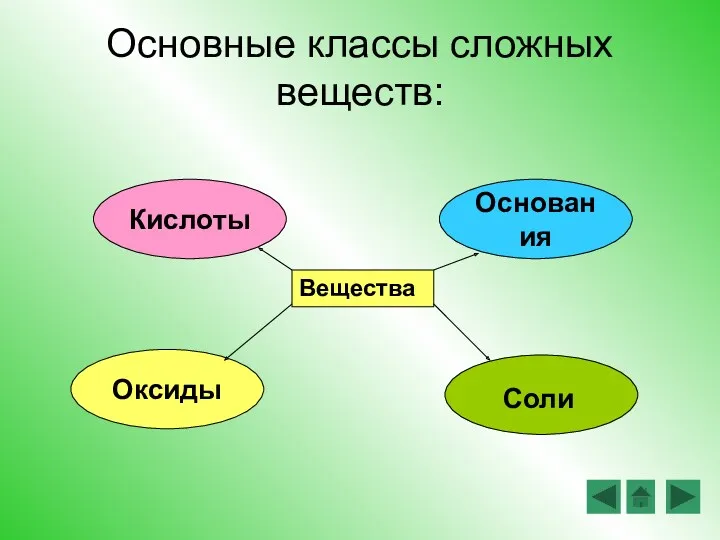
- 2. Основные классы сложных веществ: Вещества Кислоты Основания Оксиды Соли
- 3. Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со
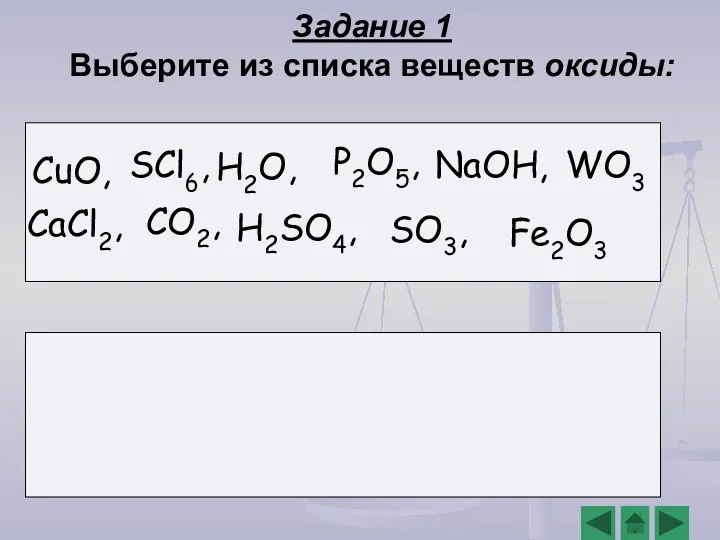
- 4. Задание 1 Выберите из списка веществ оксиды: H2O, CO2, P2O5, WO3 Fe2O3 SO3, CaCl2, SCl6, CuO,
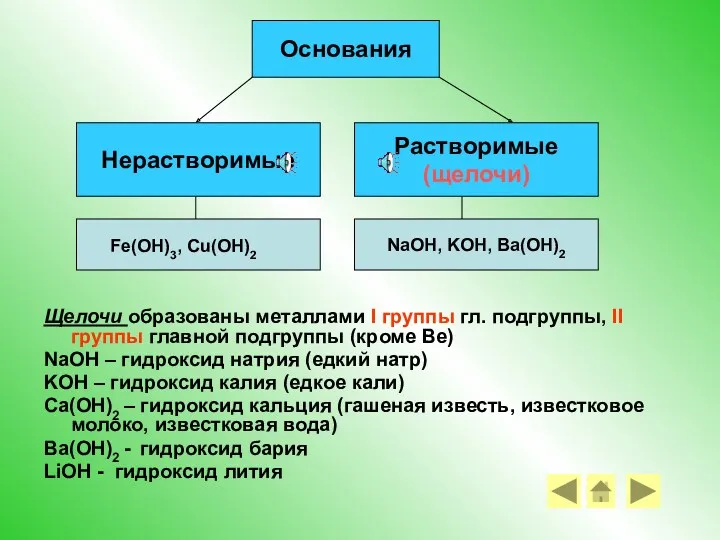
- 6. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких
- 7. Щелочи образованы металлами I группы гл. подгруппы, II группы главной подгруппы (кроме Be) NaOH – гидроксид
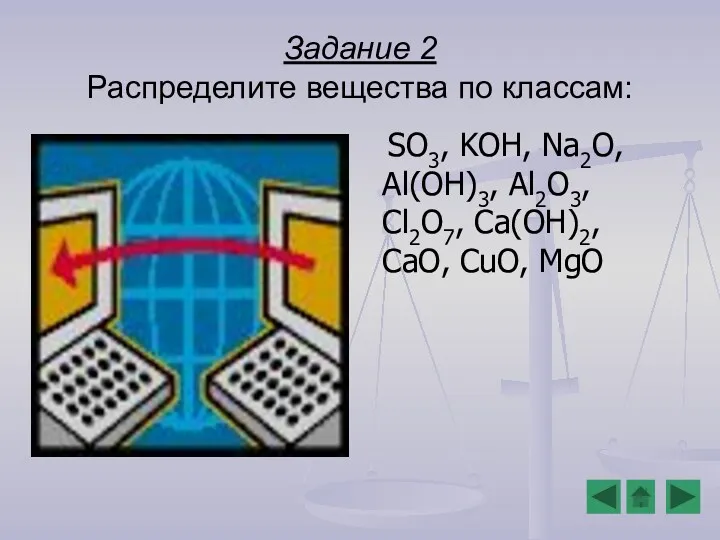
- 8. Распределите вещества по классам
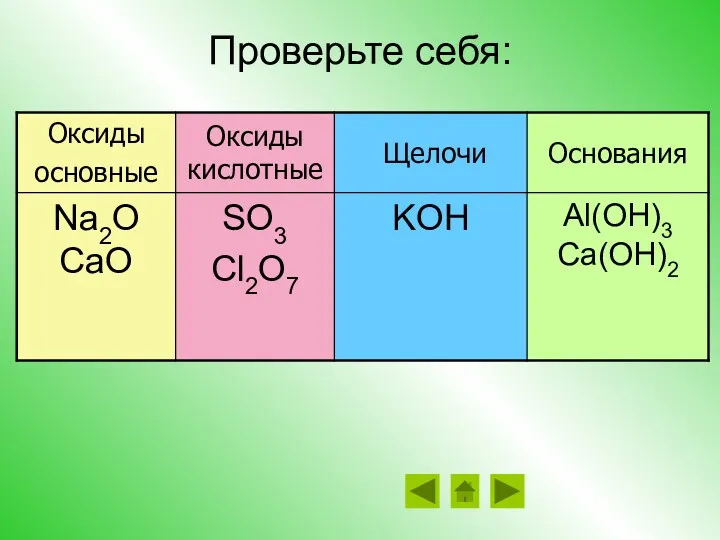
- 9. Задание 2 Распределите вещества по классам: SO3, KOH, Na2O, Al(OH)3, Al2O3, Cl2O7, Ca(OH)2, CaO, CuO, MgO
- 10. Проверьте себя:
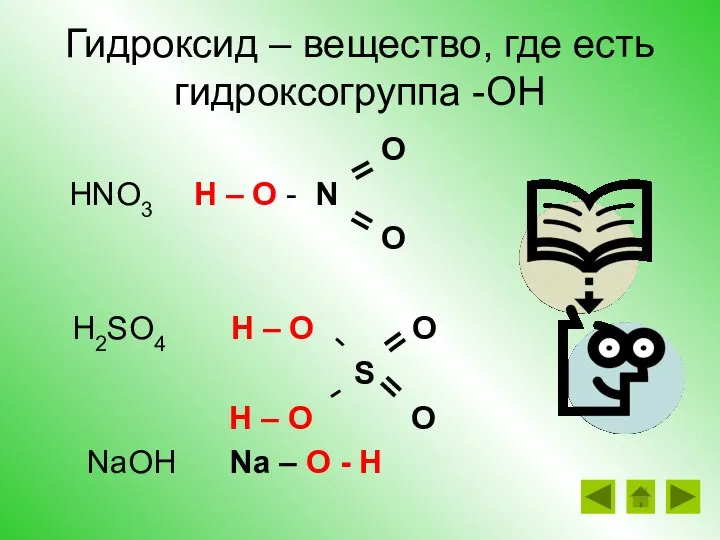
- 11. Гидроксид – вещество, где есть гидроксогруппа -ОН O HNO3 H – O - N O H2SO4
- 12. Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота
- 13. Al(OH)3 + 3HCl = AlCl3 +3H2O H3AlO3 + 3NaOH = Na3AlO3+3H2O Хлорид алюминия Алюминат натрия Запишите
- 14. Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 3NaOH = Na3AlO3 + 3H2O Как основный
- 15. Амфотерные Оксиды металлов (с.о. +2,+3,+4)
- 16. Амфотерные гидроксиды
- 17. Какие из групп веществ проявляют амфотерные свойства? Ca(ОН)2, Cu(ОН)2, NaОН, Fe(OН)2 Fe2O3, Al2O3, Fe(OН)3 , ZnO,
- 19. Скачать презентацию










 Стали и чугуны. Классификация и маркировка
Стали и чугуны. Классификация и маркировка Властивості і застосування каучуків. (Урок 15)
Властивості і застосування каучуків. (Урок 15) Химия нефти и газа
Химия нефти и газа Анализ двойных диаграмм. Лабораторная работа
Анализ двойных диаграмм. Лабораторная работа Полимеры. Классификация полимеров
Полимеры. Классификация полимеров Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості Стехиометрия и классификация твердых веществ
Стехиометрия и классификация твердых веществ Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Д. И. Менделеев человек - загадка
Д. И. Менделеев человек - загадка Ионная химическая связь
Ионная химическая связь Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Азот и его соединения
Азот и его соединения Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Алкены. Номенклатура. Строение молекулы
Алкены. Номенклатура. Строение молекулы Роль жиров в организме человека
Роль жиров в организме человека Карбонові кислоти
Карбонові кислоти Виды присадок к моторным топливам (керосин)
Виды присадок к моторным топливам (керосин) Гелий. Физико-химические свойства
Гелий. Физико-химические свойства Mercury. Mercury cycle
Mercury. Mercury cycle Тепловой эффект химической реакции. 11 класс
Тепловой эффект химической реакции. 11 класс Кремний и его соединения
Кремний и его соединения Высокомолекулярные соединения (ВМС) или полимеры
Высокомолекулярные соединения (ВМС) или полимеры Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элементов
Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элементов Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды)
Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды) Origin of petroleum dilemma
Origin of petroleum dilemma Растворимость, её зависимость от разных факторов. Насыщенные и ненасыщенные растворы
Растворимость, её зависимость от разных факторов. Насыщенные и ненасыщенные растворы Электронно-ионный баланс и Закон Авогадро. 8 класс
Электронно-ионный баланс и Закон Авогадро. 8 класс