Содержание
- 2. Закон сохранения энергии Энергия не возникает из ничего и не исчезает бесследно, а только переходит из
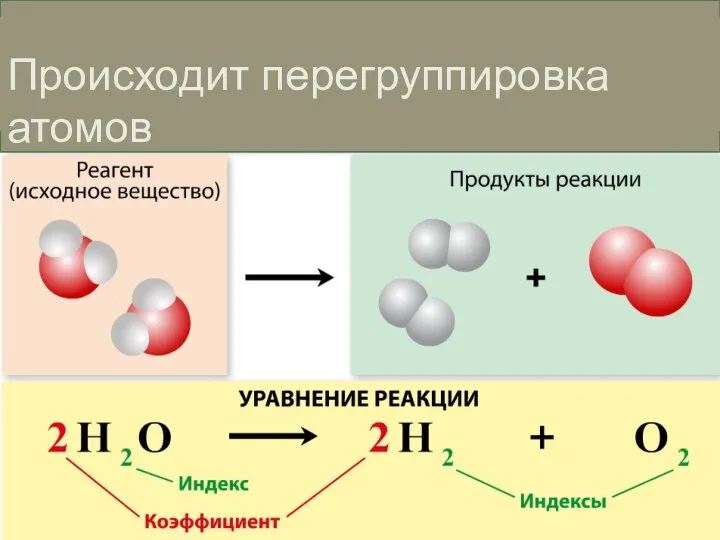
- 4. Происходит перегруппировка атомов
- 5. В ходе реакции происходит разрыв химических связей в исходных веществах и образование новых связей. При этом
- 6. Количество теплоты, которое выделяется или поглощается в результате реакции, называют тепловым эффектом данной реакции. Тепловой эффект
- 7. Эндотермическая реакция E исх. > E прод. E исх. Q = Eисх. - Eпрод. Q =
- 8. Термохимические уравнения - это уравнения, в которых указан тепловой эффект химической реакции и агрегатное состояние веществ.
- 9. уравнениям Расчёты по термохимическим
- 10. В результате реакции, термохимическое уравнение которой 2H2(г) + O2(г) = 2H2O(г) + 484 кДж, выделилось 1452
- 11. Задача 1. Q= 1452кДж m(H2O)=? Mr(H2O)=1∙2+16=18 Ar(H) = 1 Ar(O) = 16 M(H2O)= 18г/моль 2H2 +
- 12. Задача 2. В результате реакции, термохимическое уравнение которой S(тв) + O2(г) = SO2(г) + 296 кДж,
- 13. Задача 2. Дано: Т.Х.У. m(S)= 80 г Q =? M(S) = 32 г/моль Ar(S) = 32
- 14. В результате реакции, термохимическое уравнение которой: N2 + O2 = 2NО – 180 кДж получено 98
- 15. Задача 3. Дано: Т.Х.У. V(NO) = 98л Q = ? Vm = 22,4 л/моль (при н.у.)
- 16. Задача 4. В результате реакции, термохимическое уравнение которой 4NH3(г)+ 5О2(г) = 4NO(г) + 6Н2О(г) + 902
- 17. Задача 4. Дано: Т.Х.У. Q = 270,6 кДж V(NO) =? Vm = 22,4 л/моль (при н.у.)
- 18. Задача 5. Определите тепловой эффект реакции 2SO2(г) + O2(г) = 2SO3(г) + Q, если прореагировал оксид
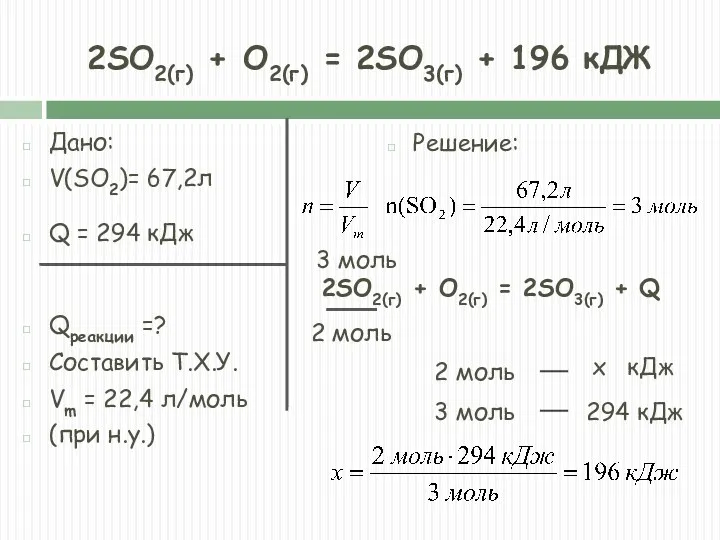
- 19. 2SO2(г) + O2(г) = 2SO3(г) + 196 кДЖ Дано: V(SO2)= 67,2л Q = 294 кДж Qреакции
- 20. Задание 1 Какое уравнение можно назвать термохимическим уравнением реакции? а) 2 H2(г) + O2(г) = 2
- 21. Задание 2 Какое уравнение соответствует эндотермической реакции? а) С(тв) + O2(г) = СO2(г) + 394 кДж
- 22. Задание 3 Даны уравнения реакций: 1) С + О2 = СО2 + 402,24кДж 2) 2HgO =
- 24. Скачать презентацию



















 Органічні сполуки (9 клас)
Органічні сполуки (9 клас) Газовые гидраты
Газовые гидраты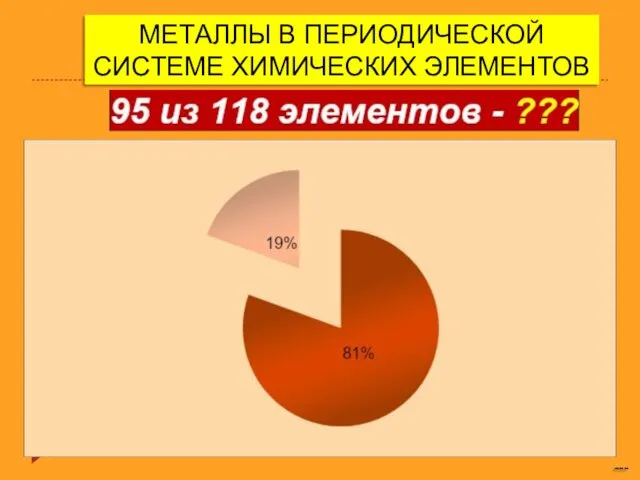 Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Моющие средства
Моющие средства Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие Дисперсні системи. Загальні властивості розчинів
Дисперсні системи. Загальні властивості розчинів Алюминий и его соединения
Алюминий и его соединения Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Термический анализ
Термический анализ Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Кислород и оксиген
Кислород и оксиген Нитраттарды қолдану
Нитраттарды қолдану Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Химия. Дисперсные системы. Растворы
Химия. Дисперсные системы. Растворы Металлы и сплавы. Общие сведения о металлах и сплавах
Металлы и сплавы. Общие сведения о металлах и сплавах Элементы VIА группы
Элементы VIА группы Химическая промышленность
Химическая промышленность Основные классы неорганических соединений
Основные классы неорганических соединений Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Нуклеиновые кислоты
Нуклеиновые кислоты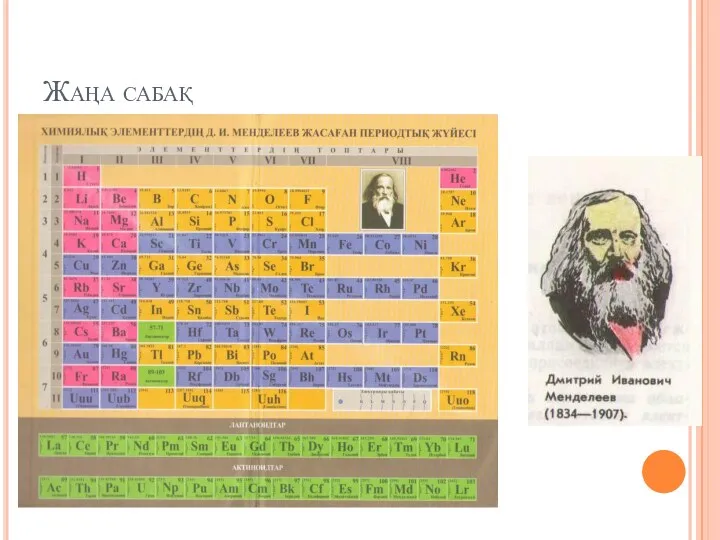 Химиялық элементтердін Д.И. Менделеев жасаған периодтық жүйесі
Химиялық элементтердін Д.И. Менделеев жасаған периодтық жүйесі Карбоновые кислоты
Карбоновые кислоты Ауыр түсті металдар
Ауыр түсті металдар