Содержание
- 2. История открытия металлов человеком до нашей эры средние века XVIII век 8 1 15
- 3. История открытия металлов человеком XIX век XX век XXI век 38 30 3
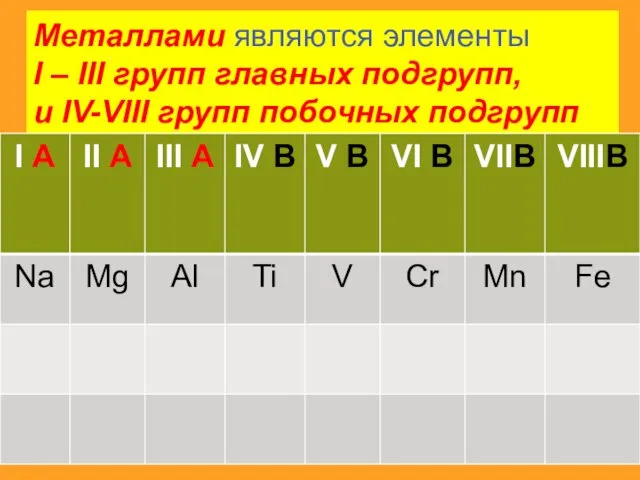
- 4. Металлами являются элементы I – III групп главных подгрупп, и IV-VIII групп побочных подгрупп
- 5. Положение элемента в ПС отражает СТРОЕНИЕ ЕГО АТОМОВ
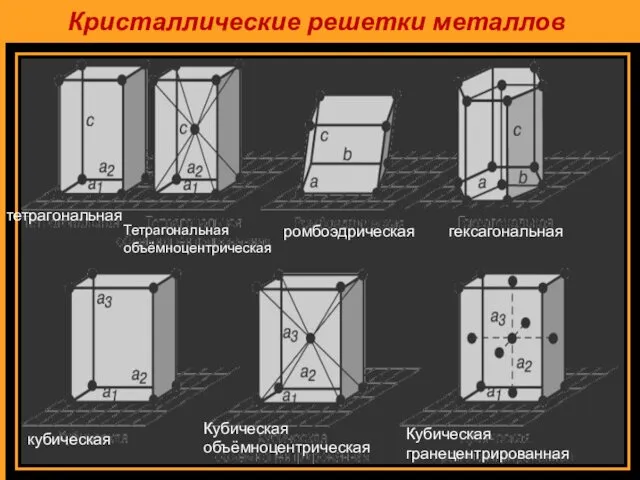
- 6. Кристаллические решетки металлов тетрагональная Тетрагональная объёмноцентрическая ромбоэдрическая гексагональная кубическая Кубическая объёмноцентрическая Кубическая гранецентрированная
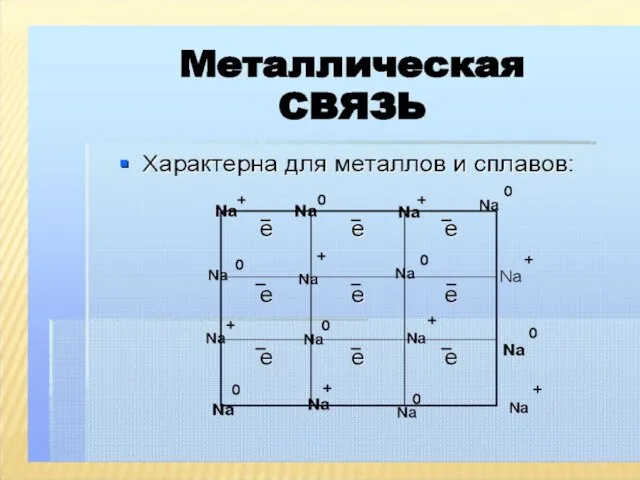
- 7. Вспомним сведения о металлической связи Какая химическая связь называется металлической? Как образуется металлическая химическая связь? Какими
- 8. 22.02.2016
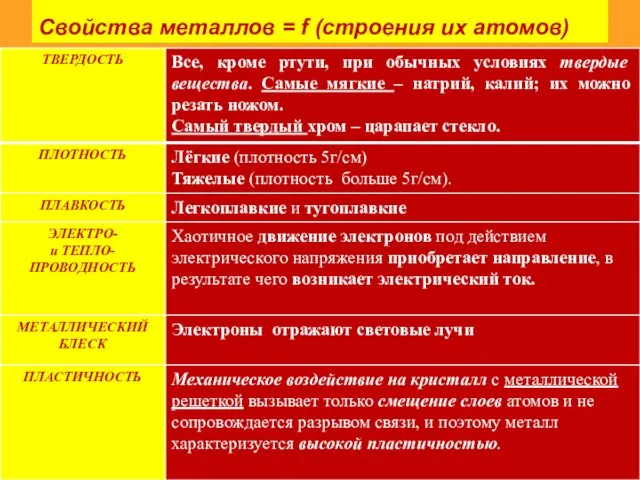
- 9. Свойства металлов = f (строения их атомов)
- 10. Металлическая связь взаимодействие, которое существует в любом металлическом изделии, состоящем из одного металла или сплава; обеспечивает
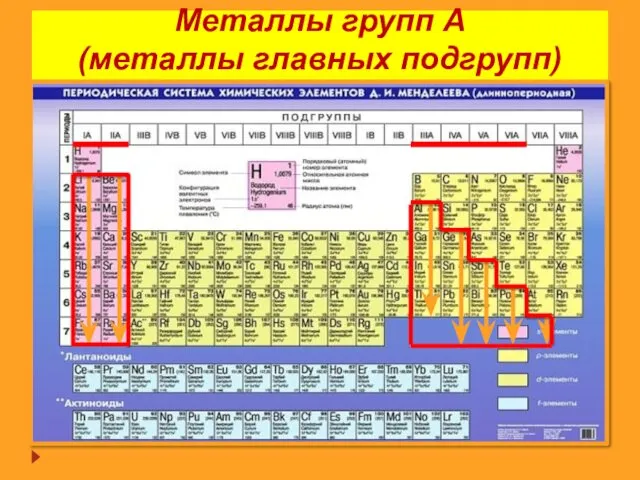
- 11. Металлы групп А (металлы главных подгрупп)
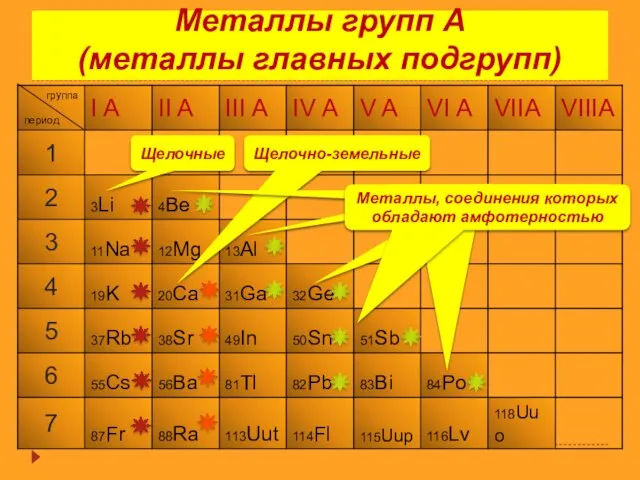
- 12. Металлы групп А (металлы главных подгрупп) Щелочные Щелочно-земельные Металлы, соединения которых обладают амфотерностью
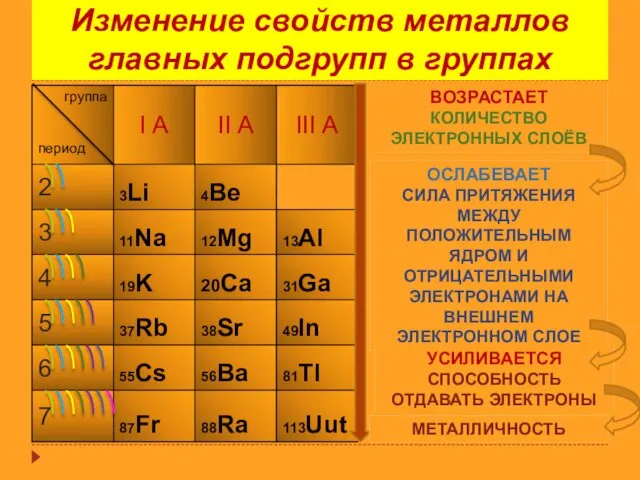
- 13. Изменение свойств металлов главных подгрупп в группах
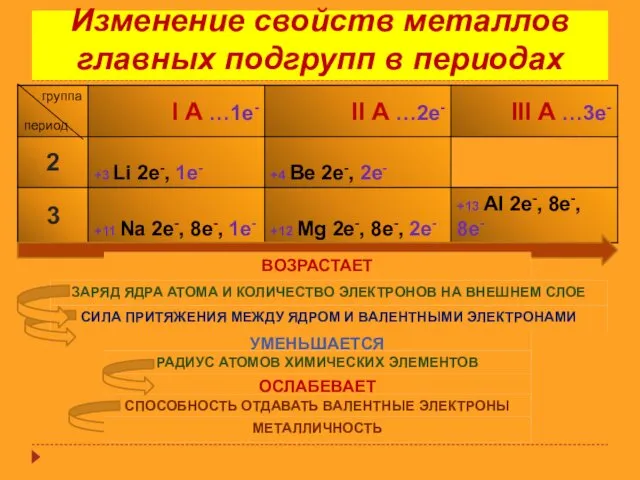
- 14. Изменение свойств металлов главных подгрупп в периодах
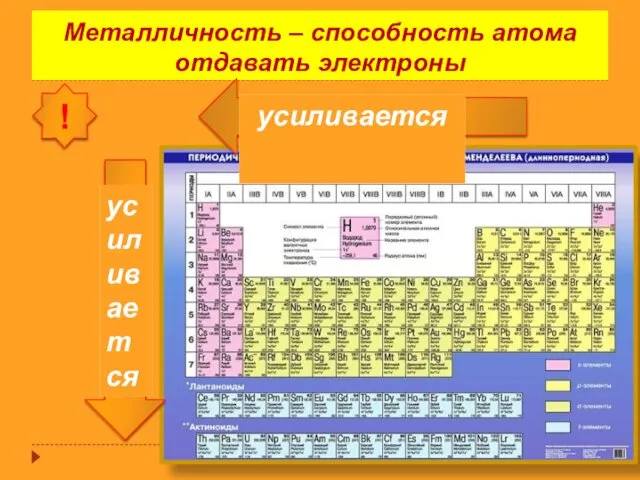
- 15. Металличность – способность атома отдавать электроны !
- 16. Металлы групп В (металлы побочных подгрупп) переходные металлы (металлы групп В)
- 17. Примерный план характеристики металла -положение в периодической системе, -строение атома, -электро-отрицательность, -валентность и степени окисления, -металличность
- 18. 22.02.2016
- 19. СuСl2 → Сu2+ 2Сl- на Катоде (восстановление): Сu2+ + 2е- = Сu0 на Аноде (окисление): 2Cl-
- 20. 22.02.2016
- 21. 22.02.2016
- 23. Скачать презентацию











 Генетическая связь между классами веществ
Генетическая связь между классами веществ Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Свойства алкадиенов и их получение
Свойства алкадиенов и их получение Ионные уравнения реакций
Ионные уравнения реакций Элементы VII группы периодической таблицы Д.И. Менделеева
Элементы VII группы периодической таблицы Д.И. Менделеева Свойства фосфора
Свойства фосфора Азотсодержащие органические соединения
Азотсодержащие органические соединения Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi
Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi Месторождения нефрита
Месторождения нефрита Значение органической химии в жизни человека
Значение органической химии в жизни человека Получение и распознавание водорода
Получение и распознавание водорода Метаморфогенные месторождения
Метаморфогенные месторождения Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Геохимия ландшафтов
Геохимия ландшафтов ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ
ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ Цветные металлы и сплавы
Цветные металлы и сплавы Серебро. История
Серебро. История Оксиды (1 этап изучения). 8 класс
Оксиды (1 этап изучения). 8 класс Базовое нефтехимическое сырье
Базовое нефтехимическое сырье Күйдіргіш натрий
Күйдіргіш натрий Никель – тяжелый металл
Никель – тяжелый металл Prezentatsia
Prezentatsia Серная кислота H2SO4
Серная кислота H2SO4 Застосування неметалів
Застосування неметалів Кислород
Кислород Периодическая система химических элементов Д.И.Менделеева
Периодическая система химических элементов Д.И.Менделеева