Содержание
- 2. Как образуется раствор?
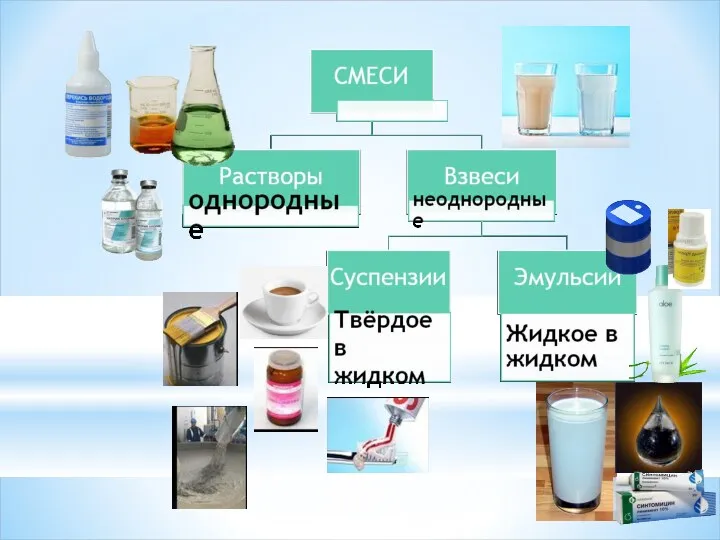
- 3. Что такое раствор? Растворы – это однородные системы, состоящие из молекул растворителя и частиц растворенного вещества,
- 4. Растворимость Способность вещества образовывать с другими веществами (растворителями) однородные системы – растворы Зависит: От природы растворяемого
- 6. Природа растворенного вещества Вещества хорошо растворимые (в 100г H2O больше 1г вещества) нерастворимые (в 100г H2O
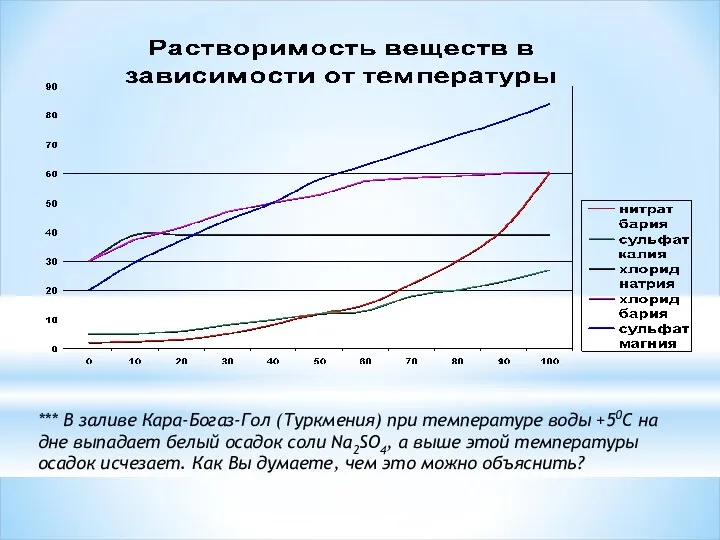
- 7. *** В заливе Кара-Богаз-Гол (Туркмения) при температуре воды +50С на дне выпадает белый осадок соли Na2SO4,
- 8. Растворимость. Растворы Коэффициент растворимости – это масса вещества (г), способная раствориться в одном литре растворителя (л)
- 9. Растворимость Решите задачу. В 400 мл. воды при 200С может раствориться 48 г. сульфата калия. Какова
- 10. Растворимость Решите задачу. Тигр приготовил при 200С 2 раствора: 5 литров раствора хлорида меди (II) –
- 11. Концентрация растворов РАСТВОРЫ разбавленные концентрированные Показатель, характеризующий количество растворенного вещества в растворе мало растворенного вещества много
- 12. Выражение концентрации растворов Один из способов выражения концентрации растворов – массовая доля (w) w w%
- 13. Задача 1. Вычислите массовую долю раствора в %, который получится, если 50 г. вещества растворили в
- 14. Решите задачи. Задача 1. Для того, чтобы обработать цветы, Винни-Пуху нужно приготовить 2 кг.2%-ного раствора нитрата
- 15. Решите задачи. Задача 3. Выполните задание тетушки Совы. Вычислите массовую долю раствора, который получится, если 120
- 16. Решите задачи. Задача 5. Машенька для бульона взяла 700 г. воды, добавила 1,5 чайных ложки соли
- 18. Скачать презентацию













 Получение уксусной кислоты и опыты с ней
Получение уксусной кислоты и опыты с ней Получение лиофобных коллоидных растворов методом пептизации на примере золя берлинской лазури
Получение лиофобных коллоидных растворов методом пептизации на примере золя берлинской лазури Реакции деструкции макромолекул
Реакции деструкции макромолекул Морфология тел полезных ископаемых
Морфология тел полезных ископаемых Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Формирование системы знаний о веществе. Лекция 14-15
Формирование системы знаний о веществе. Лекция 14-15 Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Неметаллические и композиционные материалы
Неметаллические и композиционные материалы Ненасыщенные углеводороды. Алкены
Ненасыщенные углеводороды. Алкены Многоядерные ароматические углеводороды
Многоядерные ароматические углеводороды 20190430_otkrytyy_urok_kislotypptx
20190430_otkrytyy_urok_kislotypptx Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Ионное произведение воды. Водородный показатель воды
Ионное произведение воды. Водородный показатель воды Виды присадок к моторным топливам
Виды присадок к моторным топливам Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Алюминий и его соединения
Алюминий и его соединения Фосфор и его соединения. 9 класс
Фосфор и его соединения. 9 класс Строение атома. Классификация ядер атомов
Строение атома. Классификация ядер атомов Колоїдний захист
Колоїдний захист Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Свойства, получение и применение алканов. Циклоалканы
Свойства, получение и применение алканов. Циклоалканы Электрохимическая коррозия
Электрохимическая коррозия Проект Кабинет химии будущего
Проект Кабинет химии будущего Процессы алкилирования
Процессы алкилирования Белоктар. Биохимиясы
Белоктар. Биохимиясы ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА
ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА Учение об агрегатных состояниях вещества. Газообразное состояние
Учение об агрегатных состояниях вещества. Газообразное состояние Роль хімії у розв`язанні екологічної проблеми
Роль хімії у розв`язанні екологічної проблеми