Содержание
- 2. обеспечить усвоение учащимися знаний о фосфоре как о химическом элементе и простом веществе; познакомить с аллотропными
- 3. Открытие фосфора Гамбургский алхимик Хеннинг Бранд 1669 год «Фосфор» - от греческого «светоносный»
- 4. период Фосфор как химический элемент группа валентных электронов степени окисления высший оксид водородное соединение
- 5. период Фосфор как химический элемент III группа VА валентных электронов 5 степени окисления -3, +3, +5
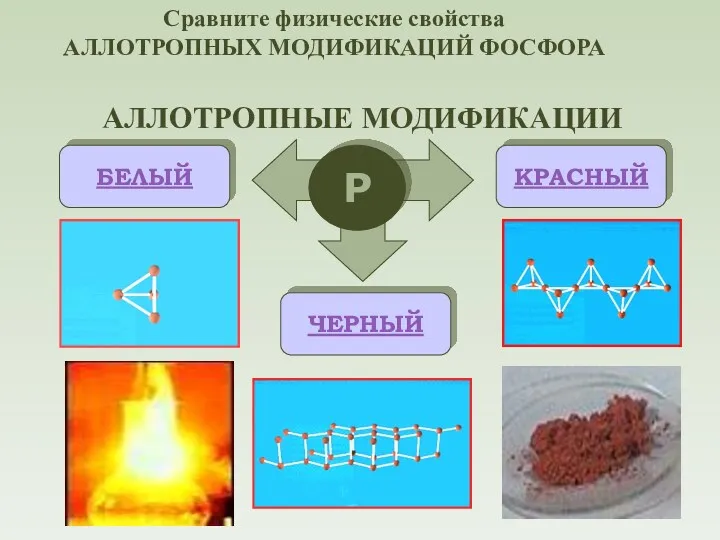
- 6. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Р БЕЛЫЙ КРАСНЫЙ ЧЕРНЫЙ Сравните физические свойства АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
- 7. Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в
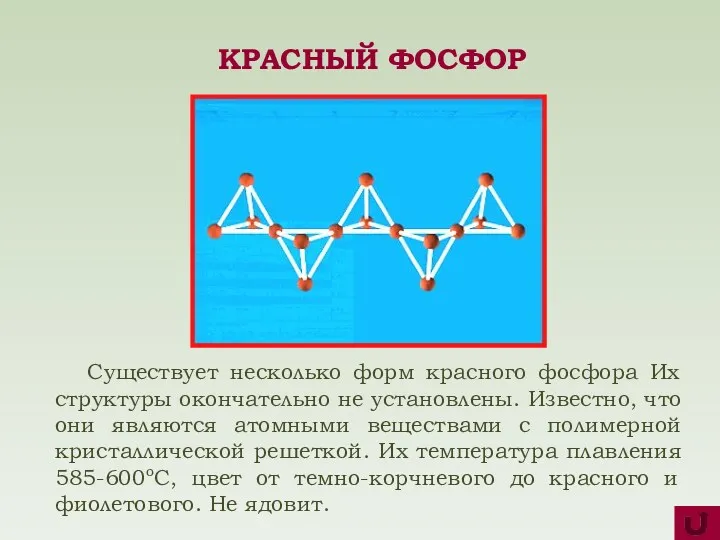
- 8. Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами
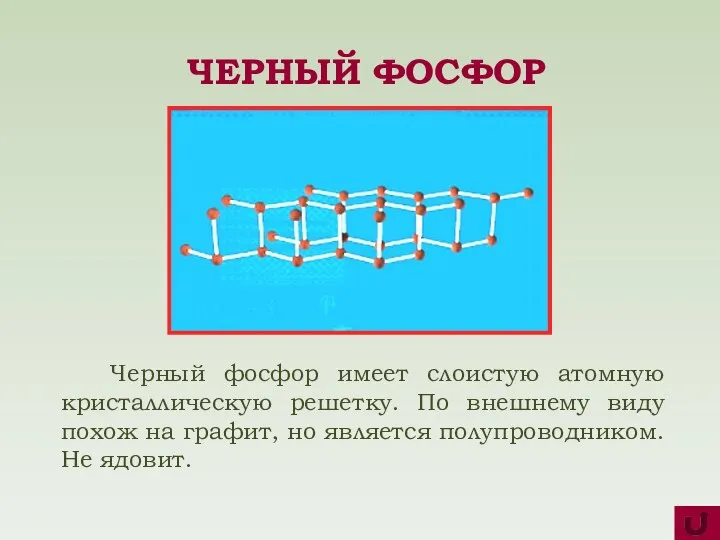
- 9. Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником.
- 10. С металлами: Ca + P = C неметаллами: P + O2 = P + S =
- 11. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
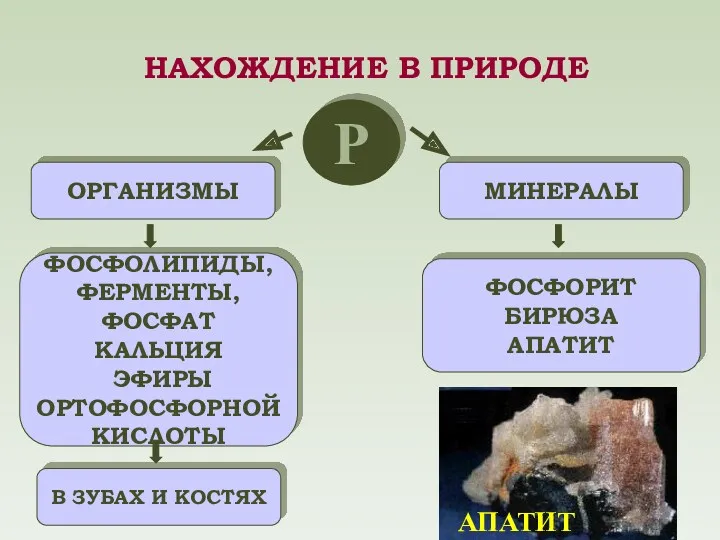
- 12. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ, ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫ В ЗУБАХ И КОСТЯХ ФОСФОРИТ БИРЮЗА
- 13. Оксиды фосфора
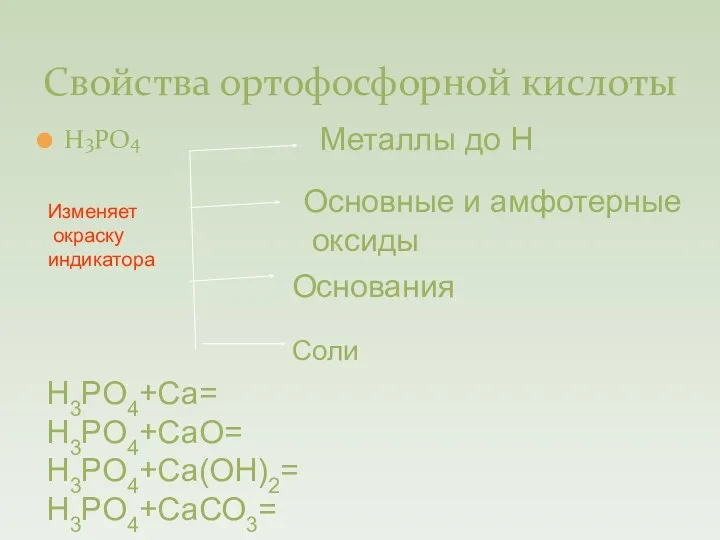
- 14. Свойства ортофосфорной кислоты Н3РО4 Металлы до Н Основные и амфотерные оксиды Основания Соли Н3РО4+Са= Н3РО4+СаО= Н3РО4+Са(ОН)2=
- 15. Фосфорная кислота и её свойства
- 16. Качественная реакция на фосфат ион- ионы серебра K3PO4+3AgNO3=Ag3PO4↓+3KNO3 при этом выпадает жёлтый осадок нитрата серебра
- 17. Физиологическое действие белого фосфора Результат применения чрезмерного количества фосфора Появление лягушек с уродствами -результат применения фосфорных
- 18. нагреванием смеси фосфорита, угля и песка в электропечи: Ca3(PO4)2 + C + SiO2 → P4 +
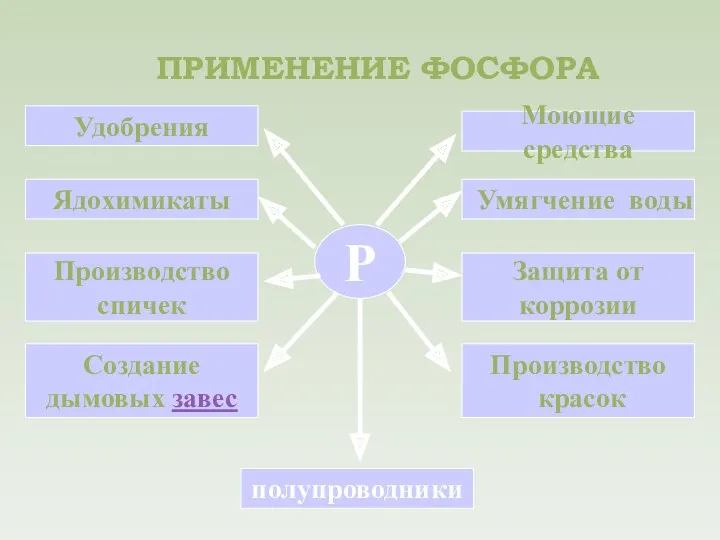
- 19. ПРИМЕНЕНИЕ ФОСФОРА Р Удобрения Ядохимикаты Производство спичек Создание дымовых завес полупроводники Производство красок Защита от коррозии
- 20. Войска США использовали фосфорные Бомбы в Ираке, 2004 г.
- 21. 2. Задача: Какова масса фосфора в вашем теле, если известно, что фосфор составляет ≈1% от массы
- 23. Скачать презентацию














 Учение о растворах
Учение о растворах Значення води і водних розчинів у природі та житті людини. Кислотні дощі
Значення води і водних розчинів у природі та житті людини. Кислотні дощі Алкалоидтар. Химиялық жіктелуі. Коммуникативті платформада G-глобалдың мәселелерін анықтау
Алкалоидтар. Химиялық жіктелуі. Коммуникативті платформада G-глобалдың мәселелерін анықтау Классификация органических соединений
Классификация органических соединений Водород. Н2
Водород. Н2 Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості Транспортное обеспечение внесения удобрений
Транспортное обеспечение внесения удобрений Амины
Амины Гидролиз неорганических соединений
Гидролиз неорганических соединений Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5) 150 лет теории строения органических соединений
150 лет теории строения органических соединений Переохлажденные жидкости и их применение. Процесс кристаллизации
Переохлажденные жидкости и их применение. Процесс кристаллизации Визначення іонів лужних і лужноземельних іонів у природних водах
Визначення іонів лужних і лужноземельних іонів у природних водах Свойства растворов электролитов
Свойства растворов электролитов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обмен нуклеопротеинов
Обмен нуклеопротеинов Атом құрылысы Сu. Биологиялық маңызы
Атом құрылысы Сu. Биологиялық маңызы Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Липиды. Классификация липидов
Липиды. Классификация липидов Пищевые добавки
Пищевые добавки Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Современные химические технологии
Современные химические технологии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Enantioselective Total Synthesis
Enantioselective Total Synthesis Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Аспирин: польза или вред?
Аспирин: польза или вред? Галогены. 9 класс
Галогены. 9 класс