Содержание
- 2. Водород – 1-й элемент Периодической таблицы (заряд ядра 1), химический знак – Н, относительная атомная масса
- 3. Если кислород является самым распространенным элементом в земной коре, то водород – самый распространенный элемент во
- 4. Вероятно, когда-то водород входил и в атмосферу Земли. Но из-за своей легкости он способен покидать атмосферу,
- 5. О водороде как элементе вы знаете уже довольно много. Атом водорода – самый простой из всех
- 6. В ядерных реакциях образуется еще один изотоп водорода – тритий, в ядре которого 1 протон и
- 7. Таким образом, известны 3 изотопа водорода: 11H (или просто H), 21H (или D), 31H (или T).
- 8. Электронный уровень 1s вмещает не более 2-х электронов и атому водорода достаточно приобрести или потерять один
- 9. Первое уравнение говорит о родственной связи водорода с элементами I группы – щелочными металлами, которые охотно
- 10. Типичными неметаллическими свойствами этот элемент больше похож на элементы VII группы (фтор, хлор, бром т.д.). Но
- 11. В земных условиях водород встречается преимущественно в связанном состоянии. Многие его соединения нам уже известны: Н2О,
- 12. 1) взаимодействие активных металлов с кислотами : Zn + 2HCl → ZnCl2 + H2 2) электролиз
- 13. 3) пропускание паров воды над раскалённым углём при 1000°C: C + H2O → CO + H2
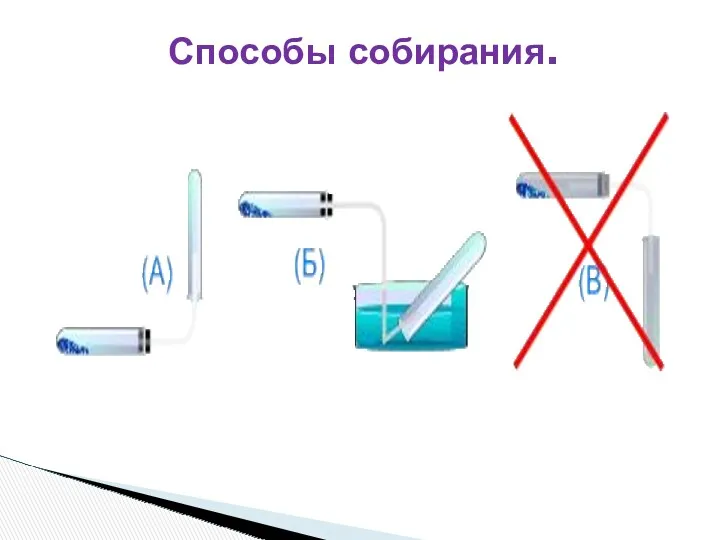
- 14. Способы собирания.
- 16. Англичанин Роберт Бойль, наблюдавший выделение газа при растворении железных опилок в соляной кислоте, дал ему в
- 17. Задачи. Сколько граммов цинка нужно взять для реакции с соляной кислотой, чтобы получить 1,12 л водорода
- 18. Водород - газ, бесцветный, без запаха; t°кип = -253°C; t°пл = -259°C; почти не растворяется в
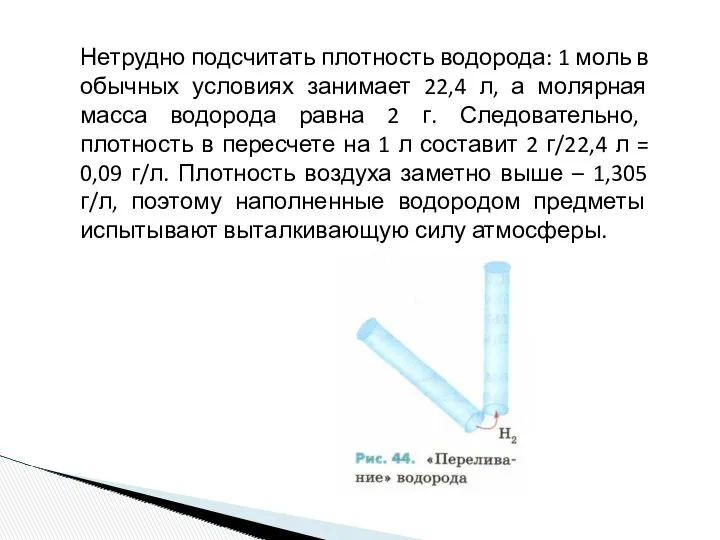
- 19. Нетрудно подсчитать плотность водорода: 1 моль в обычных условиях занимает 22,4 л, а молярная масса водорода
- 20. Водород становится жидким при очень низких температурах (-253 °С), а твердый водород получить еще труднее (температура
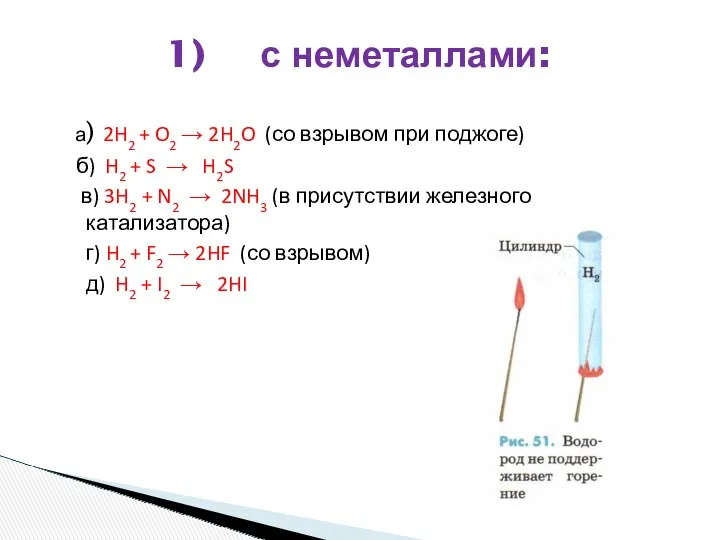
- 21. При обычных условиях малоактивен (реагирует только с фтором) С простыми веществами: Химические свойства
- 22. а) 2H2 + O2 → 2H2O (со взрывом при поджоге) б) H2 + S → H2S
- 23. H2 + 2Li →2LiH Гидрид лития H2 + Ca → CaH2 гидрид кальция 2) с щелочными
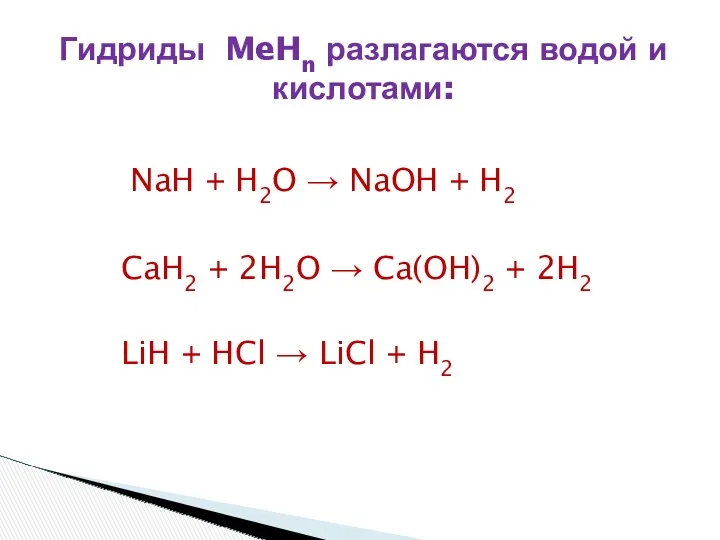
- 24. NaH + H2O → NaOH + H2 CaH2 + 2H2O → Ca(OH)2 + 2H2 LiH +
- 25. с оксидами металлов: H2 + СuO → Cu + H2O Водород является восстановителем. (метод получения малоактивных
- 26. Задачи. 3. Требуется получить 159 г меди из оксида меди CuO. Сколько граммов воды необходимо разложить
- 27. 1) Для промышленного синтеза NH3, HCl, CH3OH (реакцией CO + 2H2 → CH3OH) Применение
- 28. 2) Восстановление редких металлов из оксидов (W, Mo и др.).
- 29. 3) Наполнение метеозондов ( ранее наполняли дирижабли)
- 30. Однако большое количество энергии, выделяющееся в реакции водорода с кислородом, таит в себе огромную опасность. 6
- 31. 4) Для сварки и резки металлов водородно-кислородным пламенем.
- 32. 3) Гидрирование органических соединений (в частности, гидрогенизация растительных масел в твёрдые жиры).
- 33. Приведем количество энергии, образующейся при сжигании 1 кг различных топлив, включая водород: Водород 110 000 –
- 35. Скачать презентацию




























 Щелочные металлы
Щелочные металлы Organic Compounds
Organic Compounds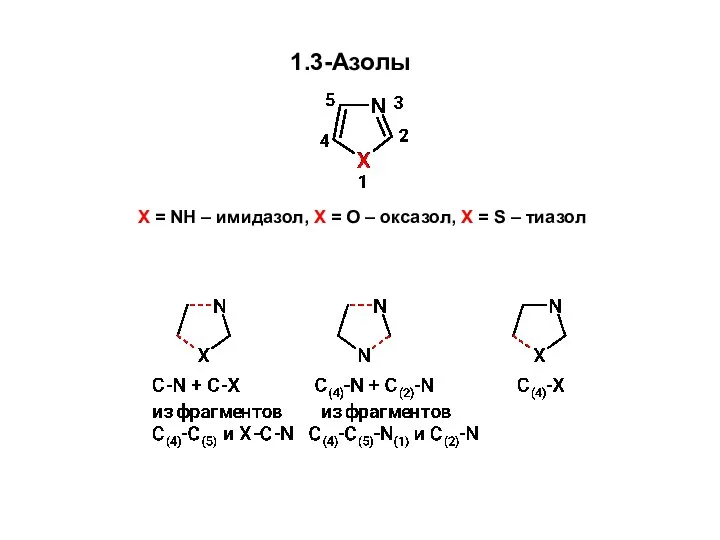 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Алкоголь
Алкоголь Алюминий и его свойства
Алюминий и его свойства Алюміній і сполуки алюмінію у побуті людини
Алюміній і сполуки алюмінію у побуті людини Молибден. Нахождение в природе
Молибден. Нахождение в природе Способы выражения состава растворов
Способы выражения состава растворов Вищі карбонові кислоти. Мило, його мийна дія. 9 клас
Вищі карбонові кислоти. Мило, його мийна дія. 9 клас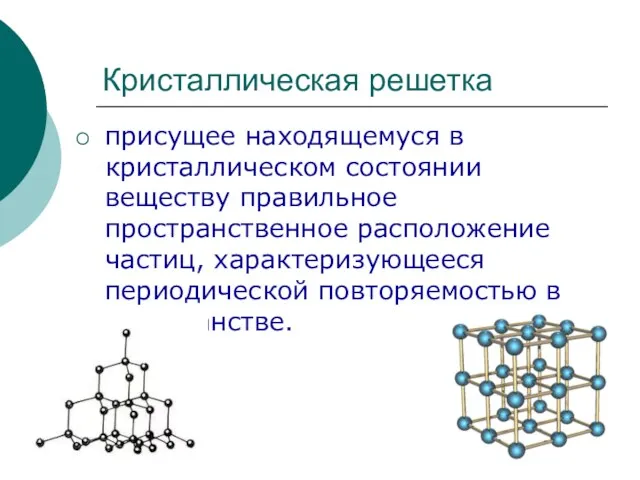 Кристаллическая решетка
Кристаллическая решетка Каменный уголь и методы его переработки
Каменный уголь и методы его переработки Геохимия. Проблемы геохимии. Геохимические методы
Геохимия. Проблемы геохимии. Геохимические методы Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Химические реакции. Классификация химических реакций
Химические реакции. Классификация химических реакций Калийные удобрения
Калийные удобрения Введение в органическую химию
Введение в органическую химию Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Свойства минералов Лекция 3
Свойства минералов Лекция 3 Germaniy gruppachasining elementlarining olinishi va xossalari
Germaniy gruppachasining elementlarining olinishi va xossalari Материаловедение. Лекция 1
Материаловедение. Лекция 1 Кислотно-основные свойства органических соединений
Кислотно-основные свойства органических соединений Этилен. Углеводороды ряда этилена
Этилен. Углеводороды ряда этилена Енергетичний баланс процесу горіння
Енергетичний баланс процесу горіння Механическая смесь и растворы
Механическая смесь и растворы