Содержание
- 2. План описания химического элемента Находим химический элемент в таблице и по его положению описываем строение его
- 4. Находим химический элемент в таблице и по его положению описываем строение его атомов.
- 5. Находим химический элемент в таблице и по его положению описываем строение его атомов. Z (число протонов)
- 6. Находим химический элемент в таблице и по его положению описываем строение его атомов. Электроны расположены на
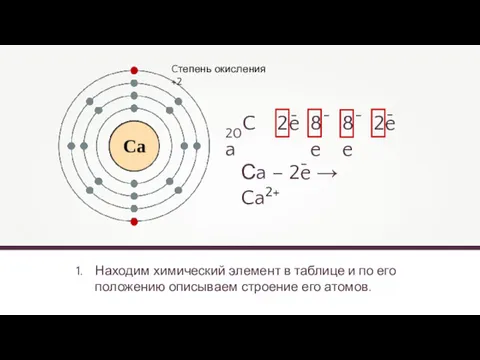
- 7. Находим химический элемент в таблице и по его положению описываем строение его атомов. 20Ca 2e 8e
- 8. 2. Отмечаем металл или неметалл, описываемый нами элемент. Jurii Кальций — металл, обладающий такими металлическими свойствами
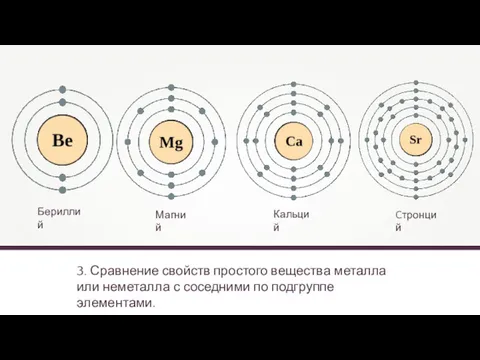
- 9. 3. Сравнение свойств простого вещества металла или неметалла с соседними по подгруппе элементами. Бериллий Кальций Магний
- 10. 4. Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами. Калий Кальций
- 11. 5. Состав и характеристика высшего оксида описываемого элемента. Оксид кальция (СaO) Оксид кальция СаО является основным
- 12. 6. Состав и характеристика высшего гидроксида. Гидроксид кальция (Ca(OH)2) Гидроксид кальция проявляет типичные свойства оснований: мылкость
- 13. 7. Состав летучего водородного соединения. Металл кальций (Ca) летучего водородного соединения не образует.
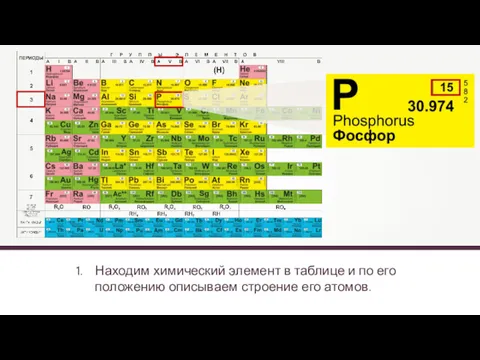
- 14. Находим химический элемент в таблице и по его положению описываем строение его атомов.
- 15. Находим химический элемент в таблице и по его положению описываем строение его атомов. Z (число протонов)
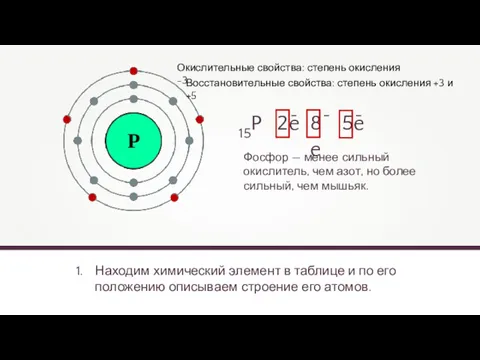
- 16. Находим химический элемент в таблице и по его положению описываем строение его атомов. 15P 2e 8e
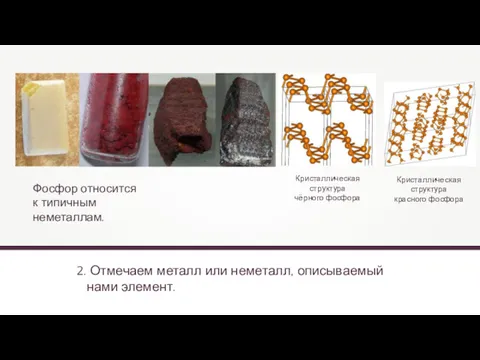
- 17. 2. Отмечаем металл или неметалл, описываемый нами элемент. Materialscientist Фосфор относится к типичным неметаллам. Кристаллическая структура
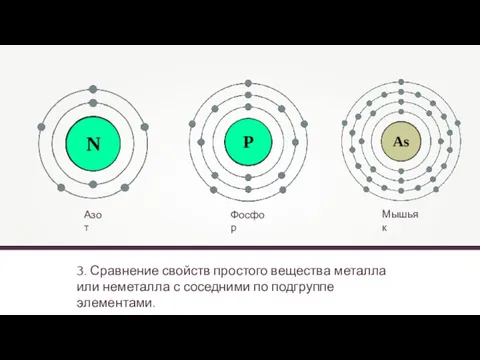
- 18. 3. Сравнение свойств простого вещества металла или неметалла с соседними по подгруппе элементами. Азот Фосфор Мышьяк
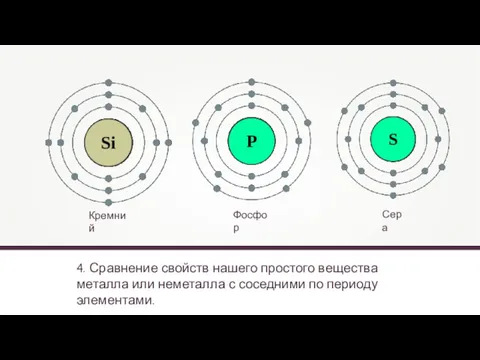
- 19. 4. Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами. Кремний Фосфор
- 20. 5. Состав и характеристика высшего оксида описываемого элемента. Оксид фосфора (Р2О5) Высший оксид фосфора (Р2О5) —
- 21. 6. Состав и характеристика высшего гидроксида. Фосфорная кислота (Н3РО4) Высший гидроксид фосфора — фосфорная кислота Н3РО4,
- 23. Скачать презентацию

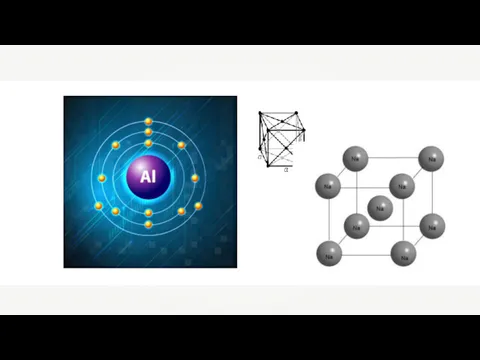










 Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Хімічні властивості металів
Хімічні властивості металів Techniques for preparation of gaseous samples with a desired concentration of analyte
Techniques for preparation of gaseous samples with a desired concentration of analyte НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Гидроксид магния. Mg(OH)2
Гидроксид магния. Mg(OH)2 Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Вуглеводи
Вуглеводи Cromatografia ionică
Cromatografia ionică Аналитические методы
Аналитические методы Каталитический риформинг
Каталитический риформинг циклоалканы170
циклоалканы170 Современные тенденции развития химии
Современные тенденции развития химии Термодинамика
Термодинамика Комплексные соединения
Комплексные соединения Алкины. Ацетилен (Этин) – С2Н2
Алкины. Ацетилен (Этин) – С2Н2 Катализ и катализаторы
Катализ и катализаторы Тепловой эффект химической реакции. 11 класс
Тепловой эффект химической реакции. 11 класс Непредельные углеводороды ряда этилена
Непредельные углеводороды ряда этилена Предмет аналитической химии, ее структура
Предмет аналитической химии, ее структура Ионы. Проверочная работа
Ионы. Проверочная работа Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии Химическая связь
Химическая связь Аммиак
Аммиак Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Алкины. 10 класс
Алкины. 10 класс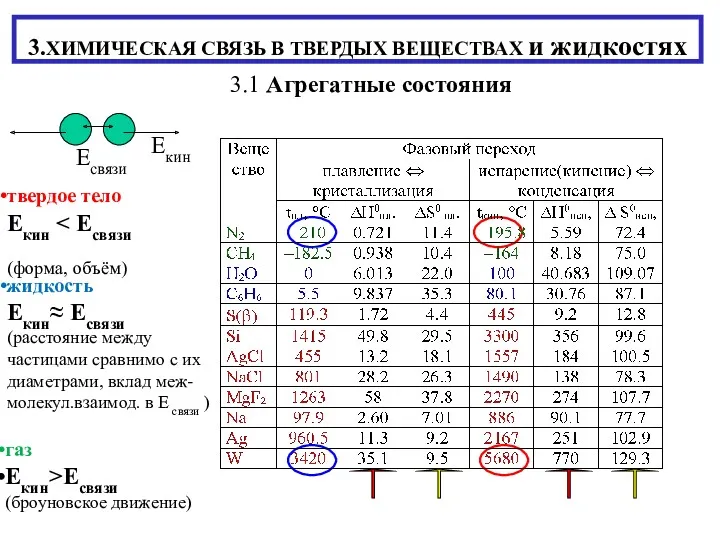 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях ae2db93272ef42dba476a56bbc56b895
ae2db93272ef42dba476a56bbc56b895