Содержание
- 2. 1. Общая характеристика Обычно среди неметаллов рассматривают также водород Н, хотя это не совсем точно, поскольку
- 3. Из 118 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ. Неметаллы характеризуются маленькими радиусами
- 4. Особенности атомного строения неметаллов Небольшой атомный радиус На внешнем уровне 4-8 электронов Располагаются только в главных
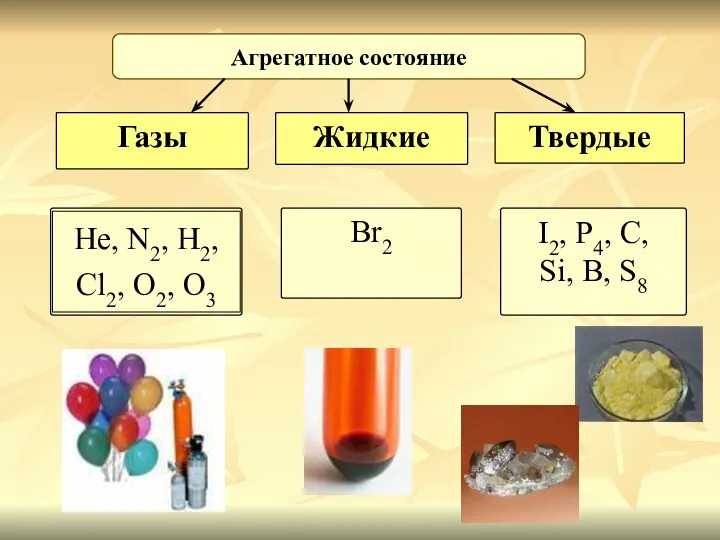
- 5. Агрегатное состояние Газы Жидкие Твердые Br2 I2, P4, C, Si, B, S8
- 6. Цвет неметаллов БЕЛЫЙ ЧЕРНЫЙ ФОСФОР ФОСФОР ГРАФИТ ЖЕЛТО-ЗЕЛЕНЫЙ ХЛОР
- 7. Цвет неметаллов КРАСНЫЙ ЖЕЛТЫЙ ФИОЛЕТОВЫЙ ФОСФОР СЕРА ЙОД БЕСЦВЕТНЫЙ УГЛЕРОД
- 8. Температура плавления 3 8000 С – у графита - 2100 С - азота
- 9. Химическая связь –ковалентная неполярная Ковалентная неполярная связь - осуществляется посредством образования общих электронных пар между атомами
- 10. Типы кристаллических решеток
- 11. Инертные или благородные газы не образуют молекул и существуют в атомарном состоянии Многие неметаллы образуют молекулу,
- 12. При обычной температуре неметаллы могут быть в разном агрегатном состоянии жидкие - Br -бром твердые –
- 13. Многие не проводят электрический ток (кроме графита и кремния). Не проводят тепло. В твердом состоянии- хрупкие
- 14. Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества –
- 15. Аллотропные формы кислорода Кислород образует две аллотропные модификации (причина- строение молекулы) Кислород O2 Газ без цвета
- 16. Свойства озона ФИЗИКО-ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ОЗОНА Озон О3 - голубованый газ с характерным резким запахом, малекулярная масса
- 17. 3. ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА Кислород – газ, без цвета и запаха, мало растворим в воде (в
- 18. 5. СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА 1. В промышленности кислород получают из воздуха. Воздух представляет собой смесь различных
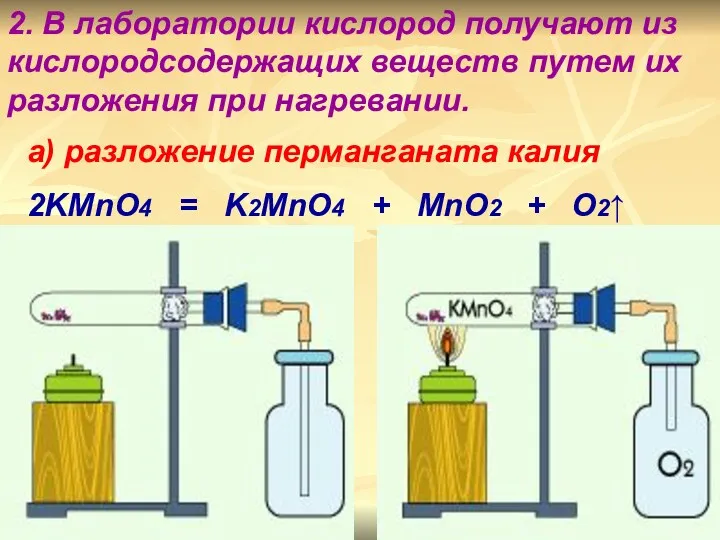
- 19. 2. В лаборатории кислород получают из кислородсодержащих веществ путем их разложения при нагревании. а) разложение перманганата
- 20. б) электролиз воды 2H2O = 2H2↑ + O2↑ в) разложение пероксида водорода 2H2O2 = 2H2O +
- 21. Аллотропные модификации углерода Углерод образует две аллотропные формы (причина – строение кристаллической решётки) Алмаз Тетраэдрическая крист.
- 22. Аллотропные модификации фосфора Фосфор образует семь аллотропных модификаций, причиной является строение кристаллической решётки. Наиболее известны две
- 23. Химические свойства неметаллов Проявляют сильные окислительные свойства, но многие могут выступать и как восстановители ( исключение
- 24. Взаимодействие с металлами: 2Na + Cl2 = 2NaCl, Fe + S = FeS, 6Li + N2
- 25. взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения – ковалентные гидриды: 3H2
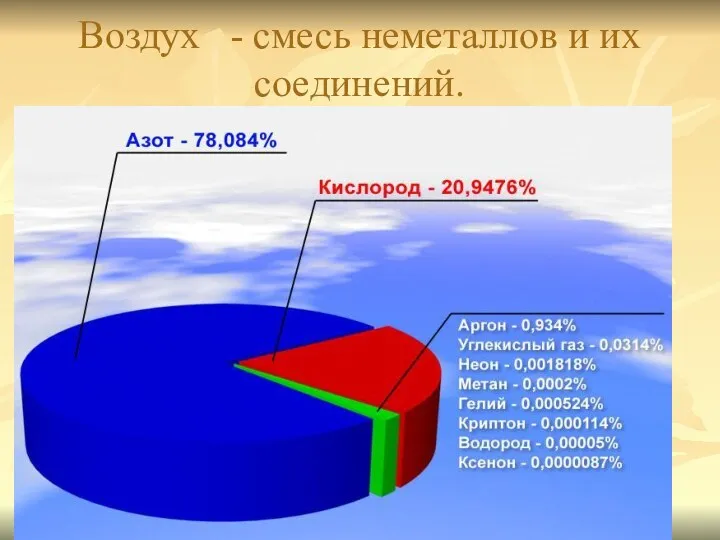
- 26. Воздух - смесь неметаллов и их соединений.
- 27. В конце 18 века А-Л. Лавуазье установил, что воздух – не простое вещество. а смесь газов
- 28. Антуан Лавуазье в 1774 году провел эксперимент и доказал, что воздух состоит на 1/5 часть из
- 29. Состав воздуха
- 30. Состав воздуха Постоянная составная часть воздуха: по объёму по массе Азот N2 78,2% 75,50% Кислород O2
- 31. Постоянные составные воздуха Азот Кислород Благородные газы
- 32. Переменные составные воздуха Углекислый газ Водяные пары Озон
- 33. Случайные составные воздуха Пыль Микроорганизмы Пыльца растений Оксиды серы и азота
- 34. Переменные составные части воздуха - это CO2 , H2O и О3 Случайные составные части воздуха –
- 35. Воздух, свободный от переменных и случайных составных частей, прозрачен, лишён цвета, вкуса и запаха, Мвоздуха= 29г/см3
- 37. Скачать презентацию






























 Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Закон сохранения массы веществ
Закон сохранения массы веществ Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий
Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий Основное уравнение молекулярно-кинетической теории. Идеальный газ
Основное уравнение молекулярно-кинетической теории. Идеальный газ Күкірт қышқылы
Күкірт қышқылы Интересные факты о химических веществах
Интересные факты о химических веществах Химическая термодинамика
Химическая термодинамика Введение в кристаллографию
Введение в кристаллографию Оксиды. Химические свойства и получение оксидов
Оксиды. Химические свойства и получение оксидов Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Приемы обращения с лабораторным оборудованием. Строение пламени
Приемы обращения с лабораторным оборудованием. Строение пламени Пластмасса, пластикалық материалдар
Пластмасса, пластикалық материалдар Предмет и задачи химии. Место химии среди естественных наук. Атомно-молекулярное учение. Основные стехиометрические законы химии
Предмет и задачи химии. Место химии среди естественных наук. Атомно-молекулярное учение. Основные стехиометрические законы химии Использование сплавов алюминия
Использование сплавов алюминия Щелочные металлы
Щелочные металлы Липиды. Составные части липидов
Липиды. Составные части липидов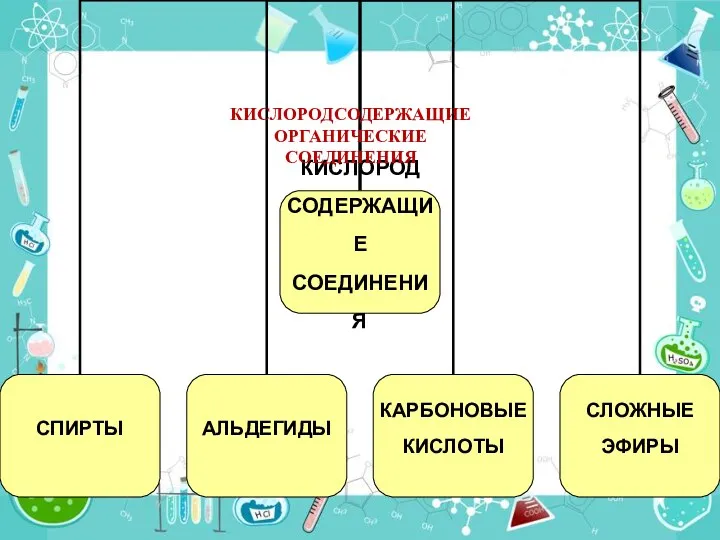 Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Йони. Йонний зв’язок, його утворення
Йони. Йонний зв’язок, його утворення Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії
Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії Вводная лекция
Вводная лекция Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Stirring in liquid media
Stirring in liquid media Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение соединения VI группы продвинутая версия
соединения VI группы продвинутая версия