Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії презентация
Содержание
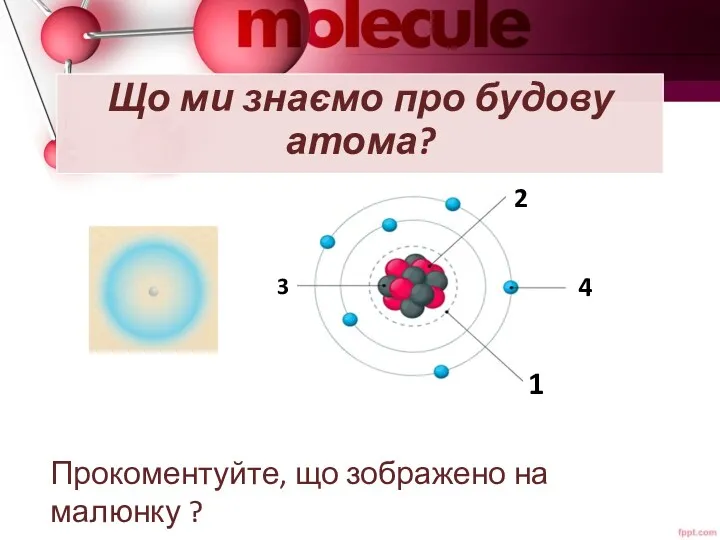
- 2. Що ми знаємо про будову атома? Прокоментуйте, що зображено на малюнку ? 3 2 4 1
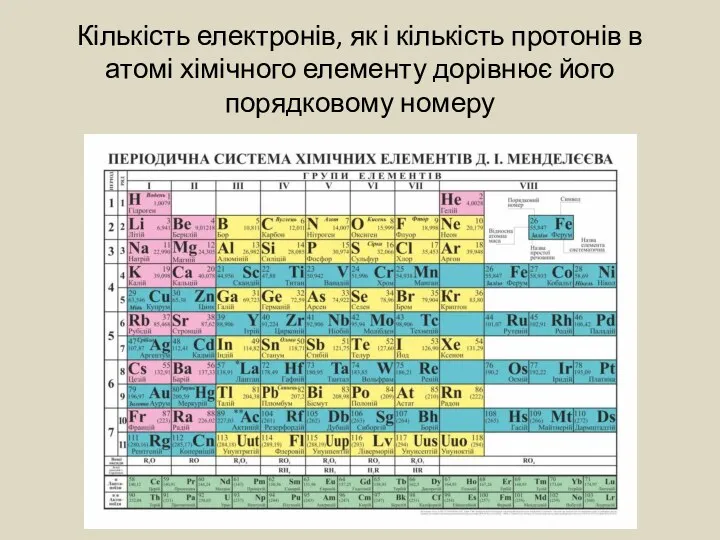
- 3. Кількість електронів, як і кількість протонів в атомі хімічного елементу дорівнює його порядковому номеру
- 4. Електрони розміщуються навколо ядра за певними правилами: 1) Електрони розподіляються по енергетичним рівням. Кількість енергетичних рівнів
- 5. 2) Електрон в атомі перебуває не в одній конкретній точці, а утворює під час руху електронну
- 6. Місткість орбіталей 3) На кожній орбіталі максимально можуть розміститися два електрони, що мають однакову енергію, але
- 7. Зазвичай електронну оболонку атомів утворює не один електрон, їх може бути до декількох десятків і навіть
- 8. Орбіталі різної форми позначають різними буквами: s, р, d і f. s-Орбіталі мають форму кулі (а),
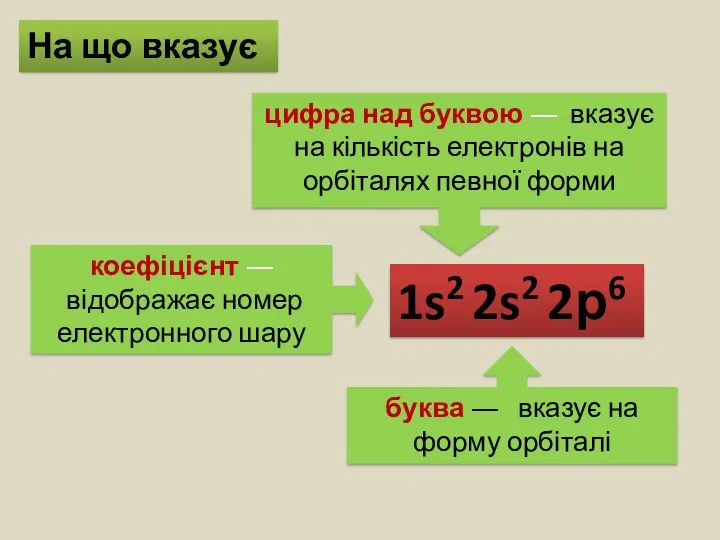
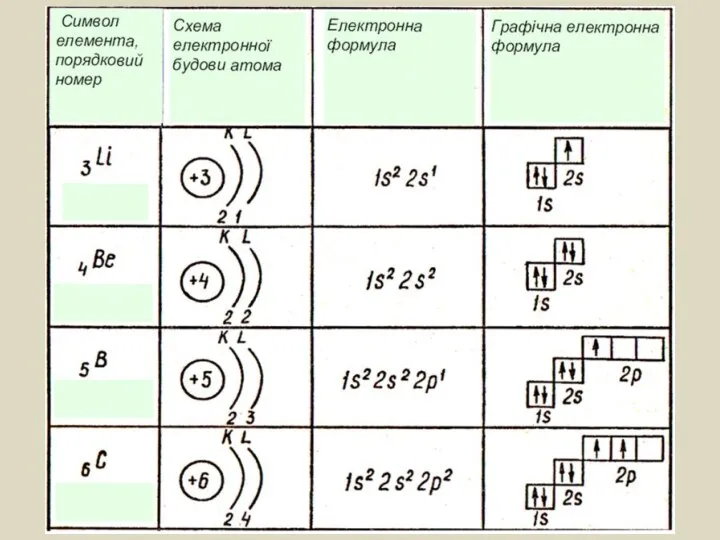
- 9. Електронна формула атома — це запис розподілу електронів в електронній оболонці атома, де коефіцієнтами позначають енергетичні
- 10. 1s2 2s2 2р6 буква ― вказує на форму орбіталі цифра над буквою ― вказує на кількість
- 11. Графічне зображення (електронні графічні формули): Графічно електрони зображують у вигляді стрілок, спрямованих догори або донизу, що
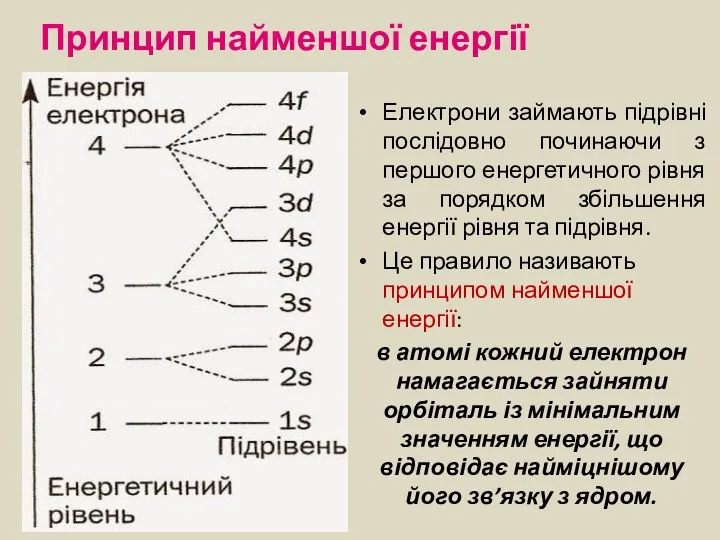
- 13. Принцип найменшої енергії Електрони займають підрівні послідовно починаючи з першого енергетичного рівня за порядком збільшення енергії
- 15. Скачать презентацию







 Общая характеристика неметаллов
Общая характеристика неметаллов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Аморфные сплавы
Аморфные сплавы Электролиз. Классификация
Электролиз. Классификация Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы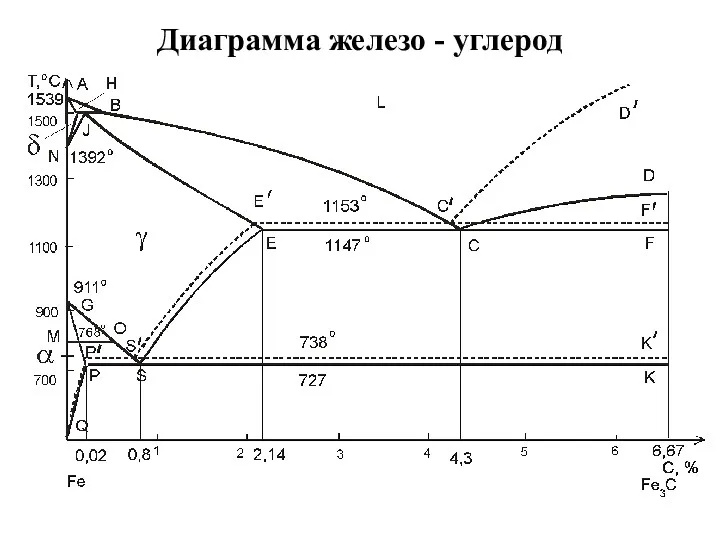 Диаграмма железо - углерод
Диаграмма железо - углерод Хром. Химиялық қасиеттері
Хром. Химиялық қасиеттері Анализ 3% раствора водорода пероксида
Анализ 3% раствора водорода пероксида Alkynes
Alkynes Металлическая связь
Металлическая связь Аминокислоты алифатического ряда и их производные
Аминокислоты алифатического ряда и их производные Комплексные соединения
Комплексные соединения Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів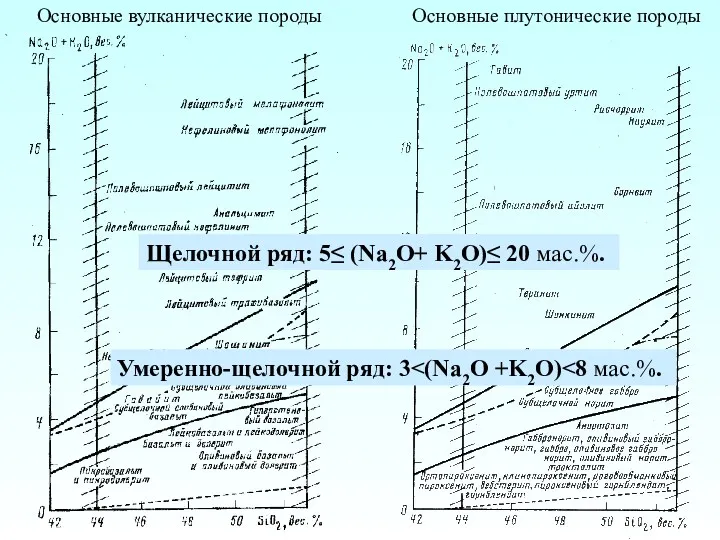 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Утворення асимілятів та їхнє перетворення
Утворення асимілятів та їхнє перетворення Технология промышленных газов
Технология промышленных газов Кислотно-основное титрование
Кислотно-основное титрование Химические свойства алкенов
Химические свойства алкенов Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Элементы пятой-А группы. Азот и фосфор
Элементы пятой-А группы. Азот и фосфор Анілін. Фізичні властивості
Анілін. Фізичні властивості Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар
Тағамдық қоспалар. Тағамдық бояулар. Антиоксиданттар. Эмульгаторлар Анализ анионов. Анализ смеси солей
Анализ анионов. Анализ смеси солей Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества 20230419_oksidy
20230419_oksidy