Содержание
- 2. Неметаллы общая характеристика
- 4. Кислород и кремний составляют 76% от массы земной коры (О – 49%, Si – 27%) C,H,O,N,
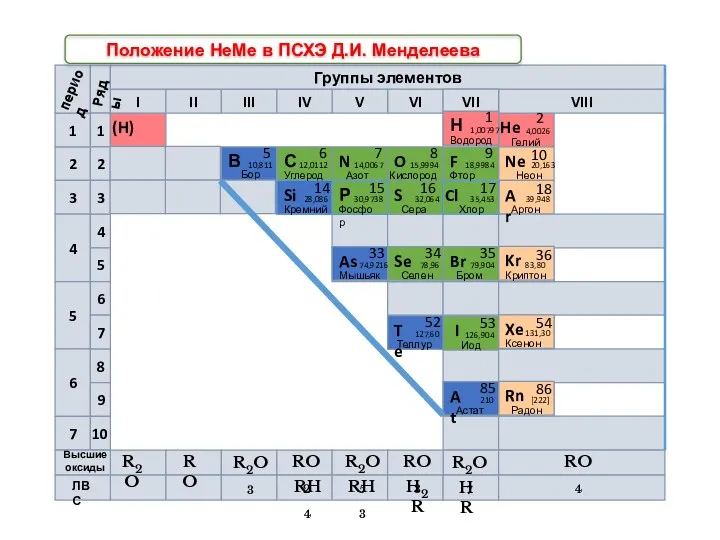
- 5. R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Высшие оксиды ЛВС Положение
- 6. Особенности атомного строения неметаллов Небольшой атомный радиус На внешнем уровне 4-8 электронов Располагаются только в главных
- 7. Сl +17 35 - 3 период , VIIА группа p+ = 17; n0 = 18; ē
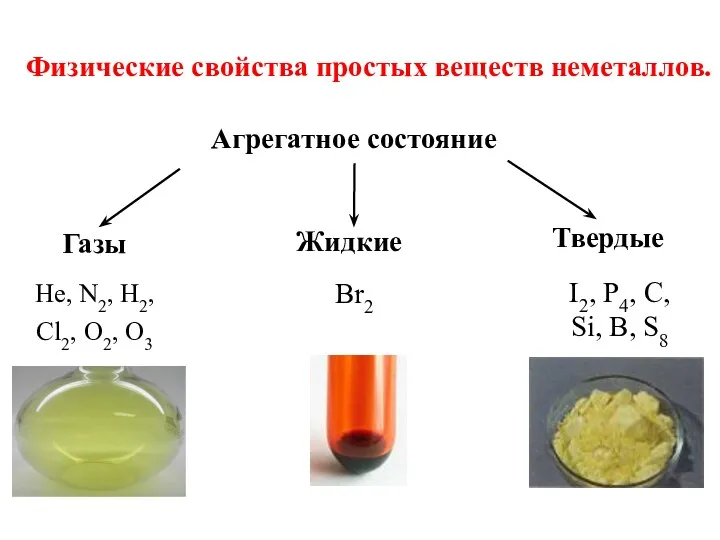
- 8. Физические свойства простых веществ неметаллов. Агрегатное состояние Газы Жидкие Твердые Br2 I2, P4, C, Si, B,
- 9. Цвет неметаллов Белый Черный Фосфор Фосфор Графит Желто-зеленый Хлор
- 10. Красный Желтый Фиолетовый Фосфор Сера Йод Бесцветный Углерод
- 11. Температура плавления 3 8000 С – у графита - 2100 С - азота
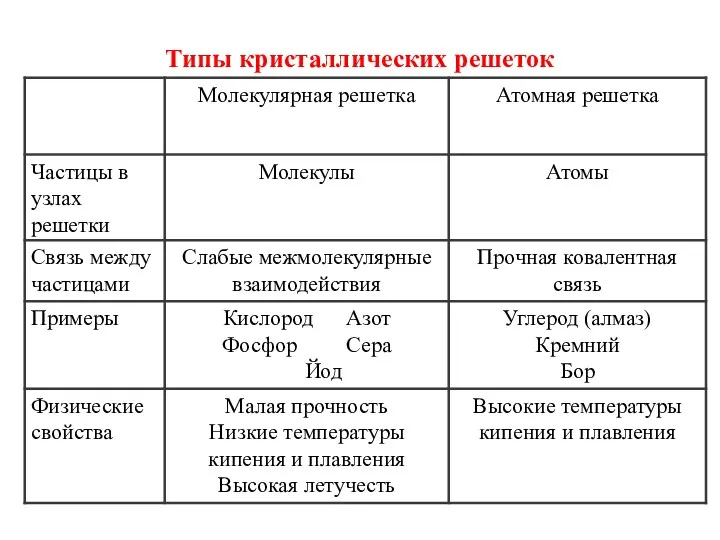
- 12. Типы кристаллических решеток
- 13. Аллотропия Аллотропия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того
- 14. Разные типы кристаллических решеток Р - фосфор Красный фосфор - атомная Белый фосфор - молекулярная
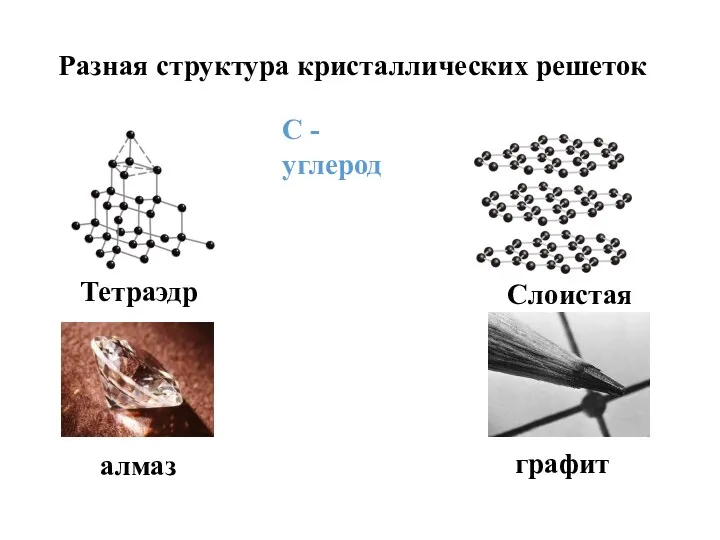
- 15. Разная структура кристаллических решеток С - углерод Тетраэдр Слоистая алмаз графит
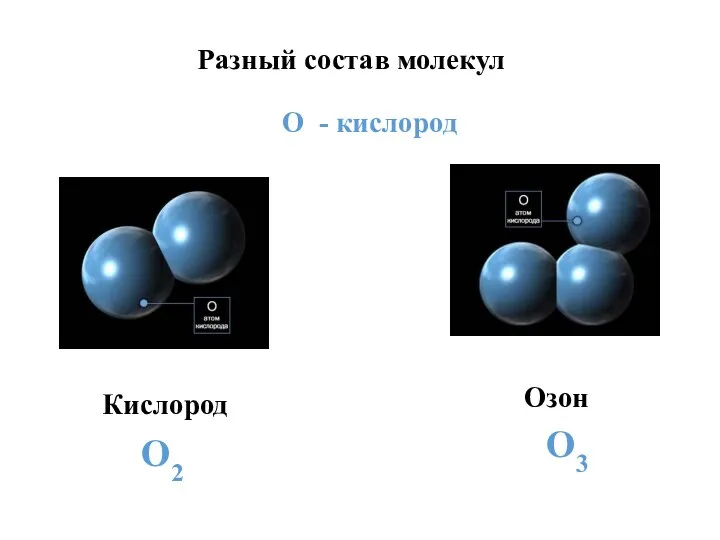
- 16. Разный состав молекул О - кислород Кислород Озон О2 О3
- 17. Химические свойства неметаллов. Неметаллы могут выступать в качестве окислителей или восстановителей. Эти способности определяются электроотрицательностью неметалла:
- 18. Окислительные свойства. 1. Взаимодействие с металлами 2K + S0 = K2S-2 3Ca + N20 = Ca3N2-3
- 19. 2. Взаимодействие с другими неметаллами. S0 + 3F20 = SF6 фторид серы (VI) +6 -1 S0
- 20. 3. Окисление сложных веществ. 2F2 + 2H2O = 4HF + O2 0 -2 -1 0 CH4
- 21. Восстановительные свойства. 1. Взаимодействие с другими неметаллами N2 + O2 ↔ 2NO 0 0 +2 -2
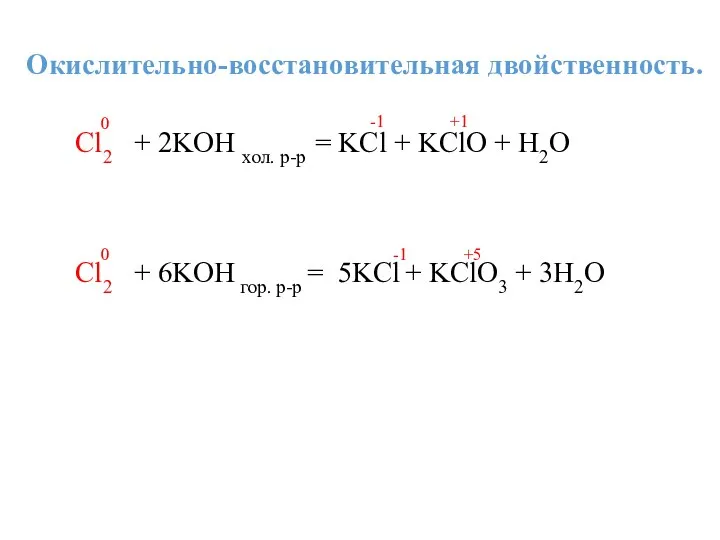
- 22. Окислительно-восстановительная двойственность. Cl2 + 2KOH хол. р-р = KCl + KClO + H2O 0 +1 -1
- 23. Домашнее задание. Принести 2-ю часть учебника. Разобрать общую характеристику неметаллов по презентации. Выучить её. Решите задачу:
- 25. Скачать презентацию
















 Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Цеолиты. Свойства и область применения
Цеолиты. Свойства и область применения Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Платина. Свойства
Платина. Свойства Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии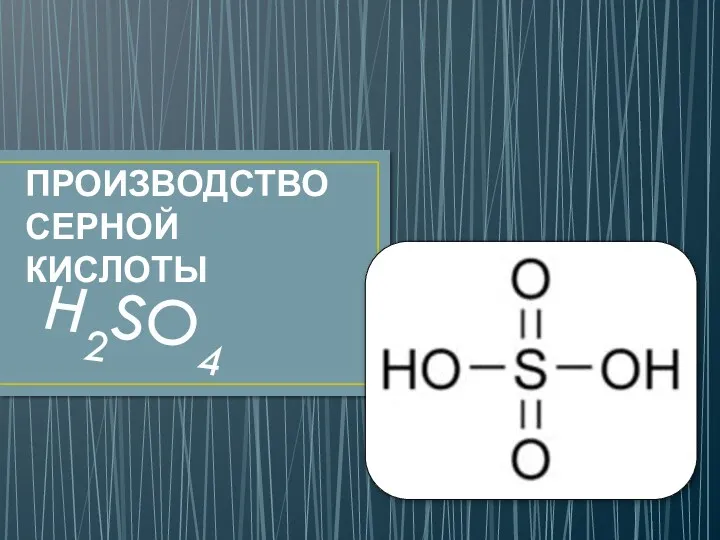 Производство серной кислоты
Производство серной кислоты Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Классификация строительных материалов. Коррозия бетона и железобетона
Классификация строительных материалов. Коррозия бетона и железобетона Органикалық қосылыстардың
Органикалық қосылыстардың Строение атома
Строение атома Ionic polymerization
Ionic polymerization Классификация автомобильных масел
Классификация автомобильных масел Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе
Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе Экспериментальные методы измерения изотерм адсорбции. Лекция 4
Экспериментальные методы измерения изотерм адсорбции. Лекция 4 Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій
Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій Производство серной кислоты
Производство серной кислоты Предмет химии. Вещества и их физические свойства
Предмет химии. Вещества и их физические свойства Отложения и коррозия
Отложения и коррозия Закон сохранения массы веществ. Урок вместе с умной колонкой
Закон сохранения массы веществ. Урок вместе с умной колонкой Металлы. Классификация металлов
Металлы. Классификация металлов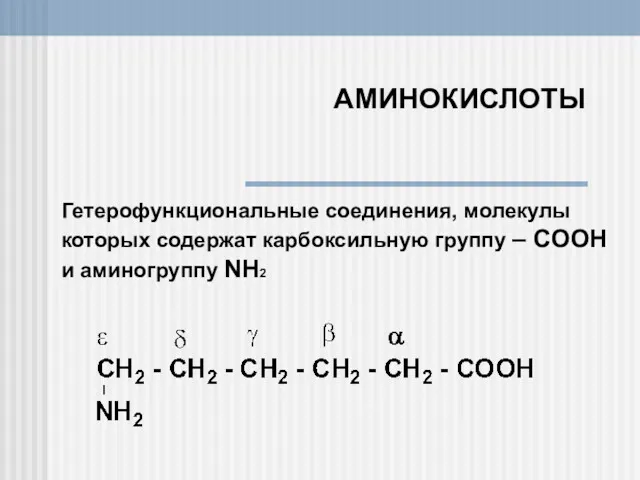 Аминокислоты. Гетерофункциональные соединения, молекулы
Аминокислоты. Гетерофункциональные соединения, молекулы Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии Происхождение химических элементов
Происхождение химических элементов Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Речовини. Молекули. Атоми
Речовини. Молекули. Атоми Химическая технология ситаллов и композитов
Химическая технология ситаллов и композитов