Содержание
- 2. Добрый день, ребята! У нас на уроке сегодня хороший друг, голосовой помощник Маруся! Если у нас
- 3. Выпишите номера предложений, где описаны химические явления. Укажите признаки химических реакций. 1. скисание молока, 2. подгорание
- 4. Закон сохранения массы веществ Масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате
- 5. Маруся расскажи нам о М.В. Ломоносове.
- 6. М.В. Ломоносов, 1756 г. «Все перемены в натуре случающиеся такого суть состояния, что сколько чего у
- 7. Спустя 41 год после опытов Ломоносова французский учёный Антуан Лоран Лавуазье практически повторил формулировку закона в
- 8. Уравнение химической реакции Это условная запись химической реакции с помощью химических формул и математических знаков 2
- 9. Правило В соответствии с законом сохранения массы веществ число атомов каждого элемента в левой и правой
- 10. Составление уравнений реакций (алгоритм) Запишите формулы исходных веществ, соединив их знаком «плюс», и поставьте стрелку Na+
- 11. Формулы простых веществ К двухатомным простым веществам относятся (при составлении химических реакций, всегда пишутся с индексом
- 12. Расставьте коэффициенты в уравнениях реакции. 1. Cu + O2 → CuO 2. HCl → H2 +Cl2
- 13. Задания на закрепление Напишите уравнения реакций, если известны исходные вещества и продукты реакции
- 14. Если у вас все получилось на уроке, то нарисуйте все если есть вопросы, то если необходимо
- 16. Скачать презентацию












 Классы неорганических соединений
Классы неорганических соединений Обмен нуклеопротеинов
Обмен нуклеопротеинов Закон сохранения массы вещества. Химические уравнения
Закон сохранения массы вещества. Химические уравнения Свойства идеального газа на примере воздуха
Свойства идеального газа на примере воздуха Выращивание кристалла медного купороса
Выращивание кристалла медного купороса Реакции ионного обмена
Реакции ионного обмена Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Электронное строение атома и Периодический закон
Электронное строение атома и Периодический закон Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Алюминий туралы мәлімет
Алюминий туралы мәлімет Коллигативные свойства растворов
Коллигативные свойства растворов Хлороводород, соляная кислота. Химические свойства соляной кислоты
Хлороводород, соляная кислота. Химические свойства соляной кислоты Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты. Урок 43
Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты. Урок 43 р-элементы V группы (пниктогены) N, P, As, Sb, Bi
р-элементы V группы (пниктогены) N, P, As, Sb, Bi Галогены. Свойства
Галогены. Свойства Химическая промышленность
Химическая промышленность Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Карбоновые кислоты
Карбоновые кислоты Органикалық заттардың ерекшелігі
Органикалық заттардың ерекшелігі Сульфидтер. Аз еруші сульфидтер
Сульфидтер. Аз еруші сульфидтер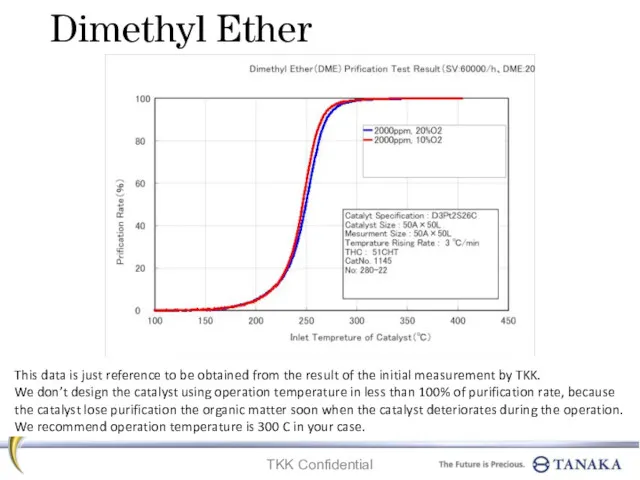 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Спирты
Спирты Кислоты. Удивительные факты
Кислоты. Удивительные факты О каком веществе идёт речь?
О каком веществе идёт речь? Водород. Строение, свойства, получение, применение
Водород. Строение, свойства, получение, применение Химическая связь
Химическая связь The nobel prize in chemistry 2020
The nobel prize in chemistry 2020 Жуғыш заттар және жуғыш әсері. 2 Лекция
Жуғыш заттар және жуғыш әсері. 2 Лекция