Содержание
- 2. Соли: свойства, получение, применение
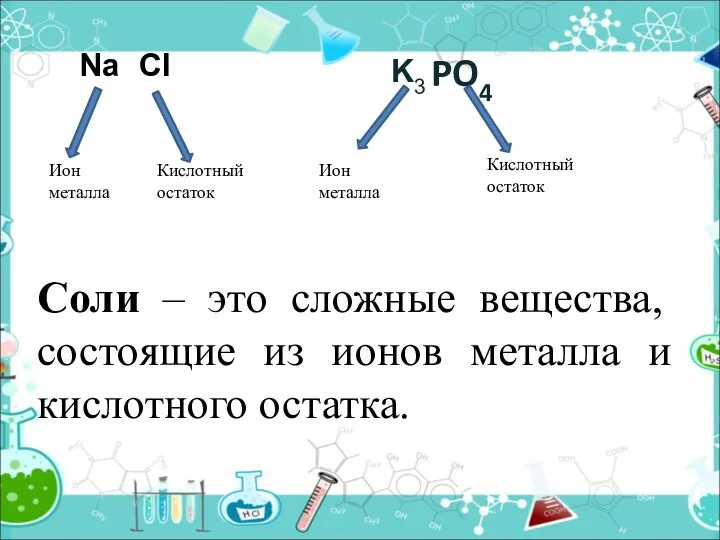
- 3. PO4 Ион металла Кислотный остаток Ион металла Кислотный остаток Na Cl K3 Соли – это сложные
- 4. Найдите среди формул веществ- формулы солей CO2 H2 SO4 CaO BaSO4 K2SO4 Fe(OH)3 HCl MgCO3 H2O
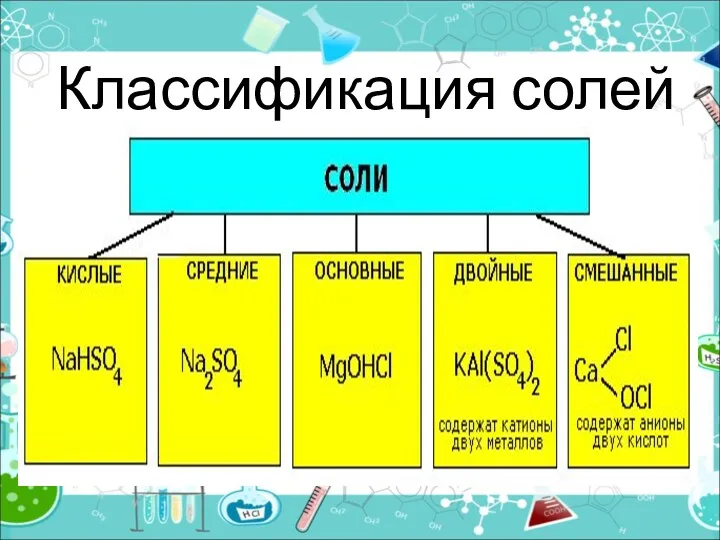
- 5. Классификация солей
- 6. Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла (KCl) Кислые
- 7. Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей
- 8. Номенклатура средних солей магния Название кислотного остатка Наименование металла в родительном падеже МgСL2 хлорид
- 9. Номенклатура кислых солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в
- 10. Номенклатура основных солей Указать название кислотного остатка К названию кислотного остатка прибавить «основной-» Наименование металла в
- 11. Номенклатура двойных солей таллия (I) -натрия Название кислотного остатка Наименование металлов в родительном падеже NaTl(NO3)2 нитрат
- 12. Номенклатура смешанных солей кальция Название кислотных остатков Наименование металла в родительном падеже CaCLOCL хлорид-гипохлорит
- 13. Составить формулы солей: нитрита магния, силиката натрия, фосфата кальция.
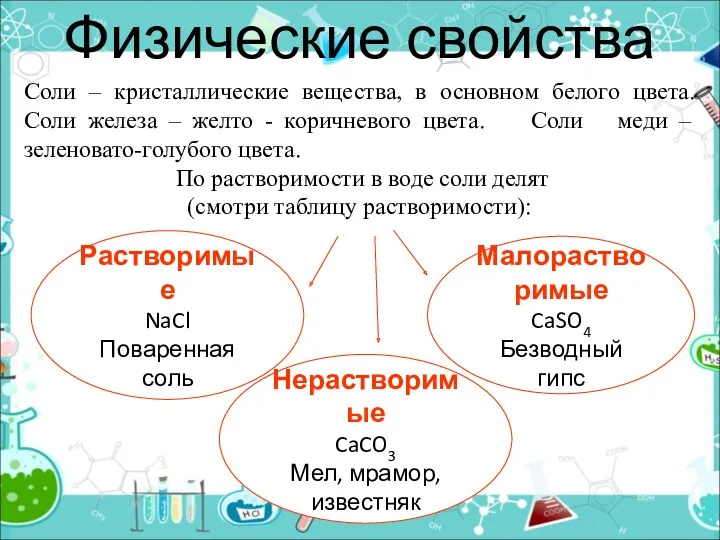
- 14. Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа
- 15. Химические свойства 1. Взаимодействие с металлами. Каждый левее стоящий металл в ряду напряжений вытесняет последующий из
- 16. Химические свойства 2. Взаимодействие со щелочами: В результате обязательно должно образоваться нерастворимое основание. 3. Взаимодействие солей
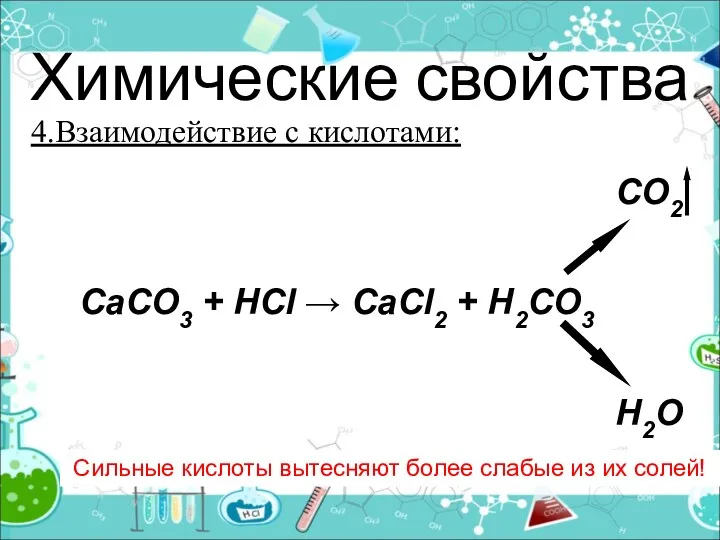
- 17. Химические свойства 4.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO2 CaCO3 +
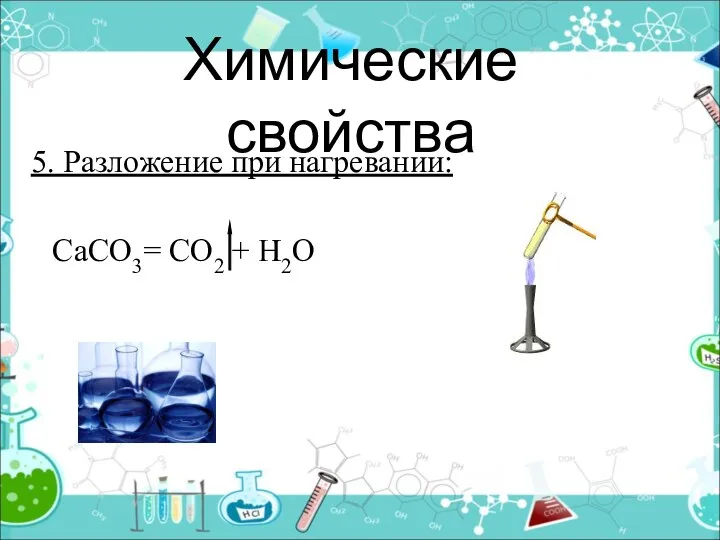
- 18. Химические свойства 5. Разложение при нагревании: СаСО3= СО2 + Н2О
- 19. Способы получения 1. Кислота + основание = соль + вода H2SO4 +2NaOH = Na2SO4 + 2H2O
- 20. Способы получения 5. Основание + соль = новое основание + новая соль 2КОН + СаSO4 =
- 21. Применение солей Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид
- 22. Применение солей Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при
- 23. Применение солей Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим
- 24. Применение солей Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия
- 25. Розовое озеро в Сенегале Это озеро имеет такой цвет из-за большого количества микроорганизмов и полезных ископаемых.
- 26. Самое большое солевое озеро в мире расположено на юге пустынной равнины Альтиплано, в Боливии, на высоте
- 27. Домашнее задание Дать название солям NaCl KNO3 Li2SO4 KHSO4 NaH2PO4 2. Составьте химические формулы солей по
- 29. Скачать презентацию





















 Титриметрический метод анализа
Титриметрический метод анализа Лекция 3. Разновидности химических связей
Лекция 3. Разновидности химических связей Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Хімічні явища в побуті
Хімічні явища в побуті Железо и его свойства
Железо и его свойства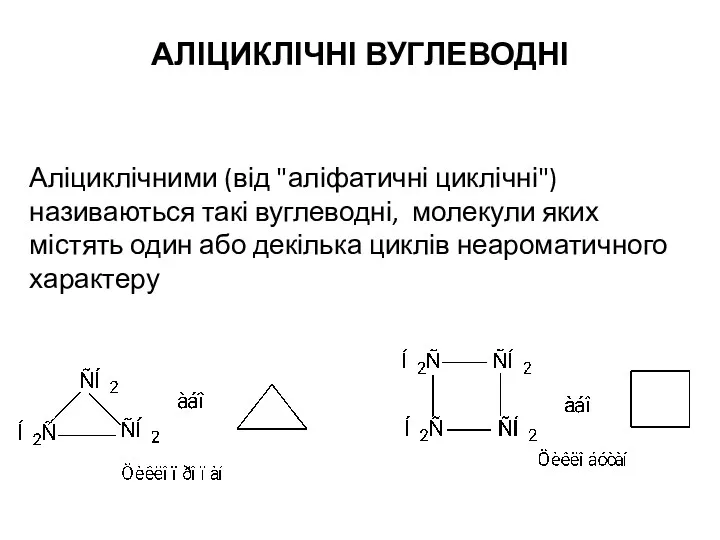 Аліциклічні вуглеводні
Аліциклічні вуглеводні Соединения серы
Соединения серы Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Конструкционные функциональные волокнистые композиты. Стеклопластики
Конструкционные функциональные волокнистые композиты. Стеклопластики Удивительные свойства воды
Удивительные свойства воды Азотсодержащие органические соединения. Амины. Анилинароматический амин
Азотсодержащие органические соединения. Амины. Анилинароматический амин Романенко
Романенко Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями Бета-окисление жирных кислот
Бета-окисление жирных кислот Дизельное топливо. Требования, предъявляемые к дизельным топливам
Дизельное топливо. Требования, предъявляемые к дизельным топливам Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь
Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Анализ и синтез химических веществ
Анализ и синтез химических веществ Обчислення об'ємних відношень газів за хімічними рівняннями. Хімія. 9 клас
Обчислення об'ємних відношень газів за хімічними рівняннями. Хімія. 9 клас Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронного баланса для уравнивания окислительно-восстановительных реакций Общие способы получения металлов
Общие способы получения металлов История развития промышленности переработки полимеров
История развития промышленности переработки полимеров Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Геохимия гранитоидов, зоны гипергенеза, осадочного процесса
Геохимия гранитоидов, зоны гипергенеза, осадочного процесса