Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь презентация
Содержание
- 2. Распределение электронов по энергетическим уровням и подуровням изображают в виде электронных формул и энергетических ячеек так
- 3. В графических электронных формулах каждая орбиталь обозначается клеткой, стрелка − электрон, направление стрелки − направление спина,
- 4. 1. Принцип Паули В атоме не существует двух электронов с одинаковым набором квантовых чисел. Максимальное число
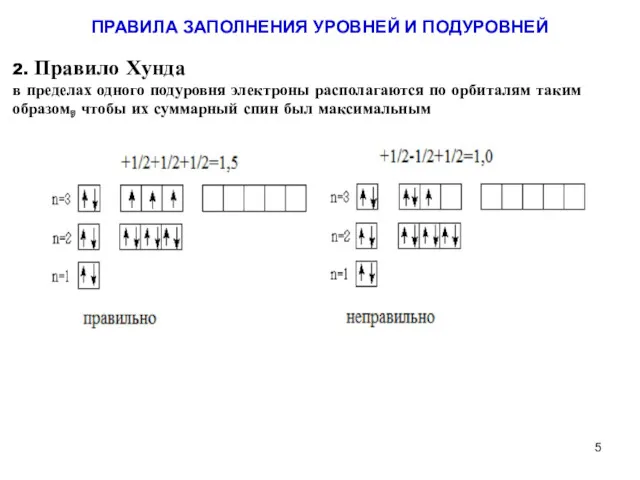
- 5. 2. Правило Хунда в пределах одного подуровня электроны располагаются по орбиталям таким образом, чтобы их суммарный
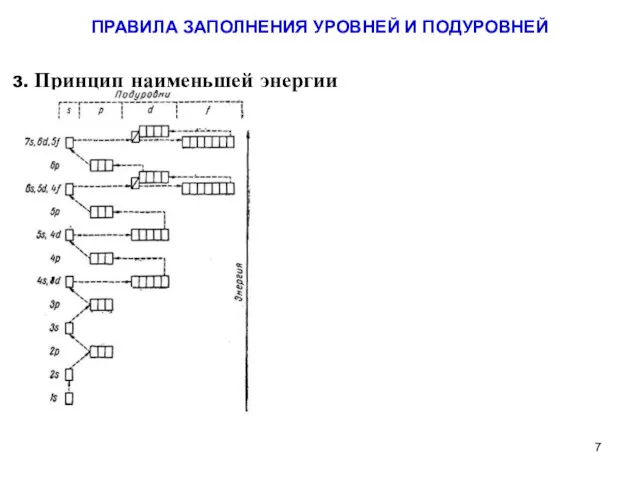
- 6. 3. Принцип наименьшей энергии электроны заполняют орбитали в порядке возрастания энергии орбиталей. Принцип реализован в правиле
- 7. 3. Принцип наименьшей энергии ПРАВИЛА ЗАПОЛНЕНИЯ УРОВНЕЙ И ПОДУРОВНЕЙ
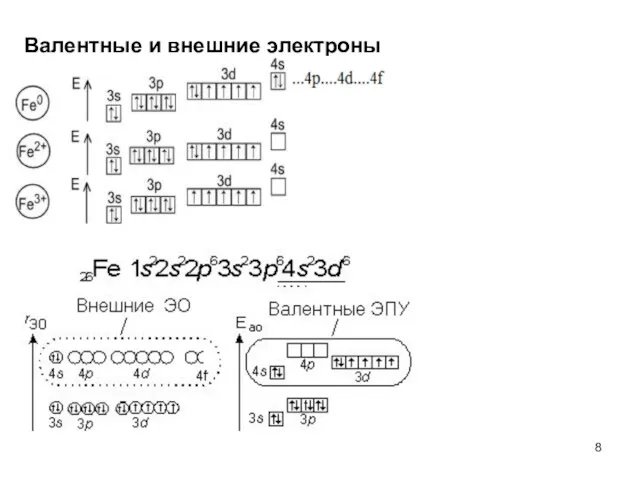
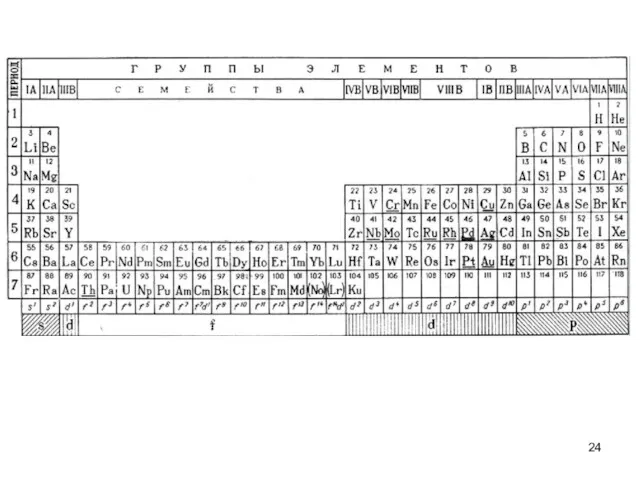
- 8. Валентные и внешние электроны
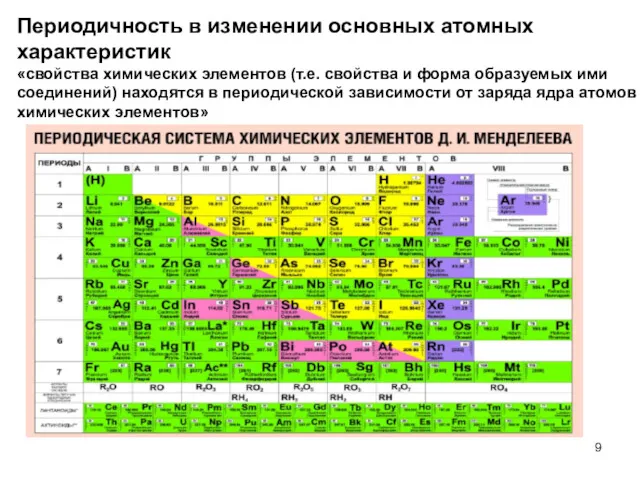
- 9. Периодичность в изменении основных атомных характеристик «свойства химических элементов (т.е. свойства и форма образуемых ими соединений)
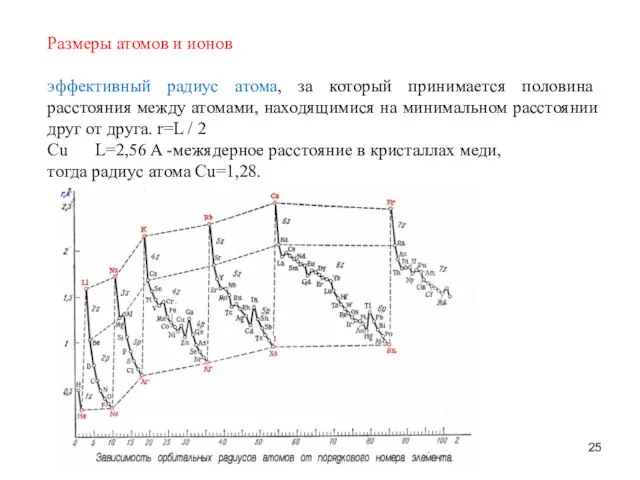
- 25. Размеры атомов и ионов эффективный радиус атома, за который принимается половина расстояния между атомами, находящимися на
- 26. Энергия ионизации Как потеря, так и присоединение атомами электронов сопровождается энергетическим эффектом. Количество энергии, которое необходимо
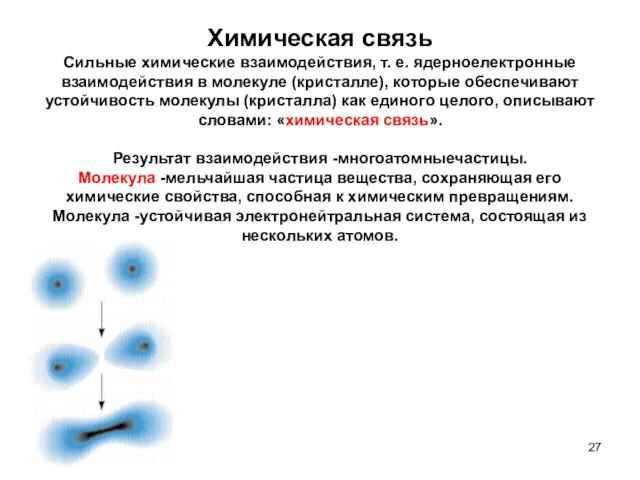
- 27. Химическая связь Сильные химические взаимодействия, т. е. ядерноелектронные взаимодействия в молекуле (кристалле), которые обеспечивают устойчивость молекулы
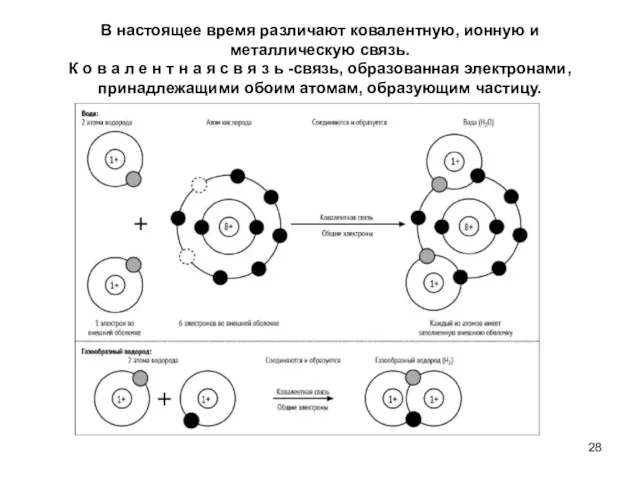
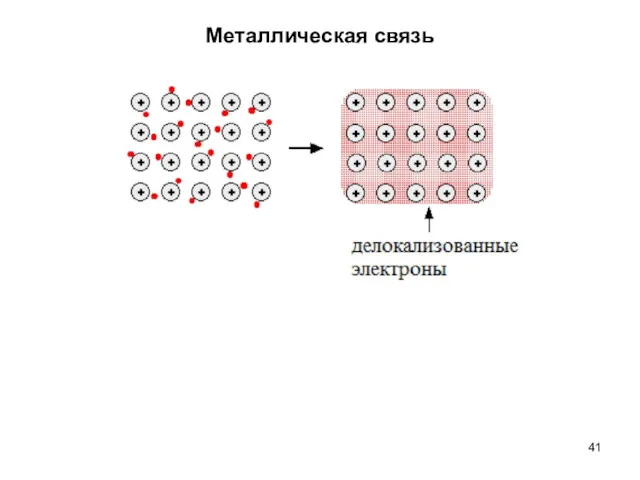
- 28. В настоящее время различают ковалентную, ионную и металлическую связь. К о в а л е н
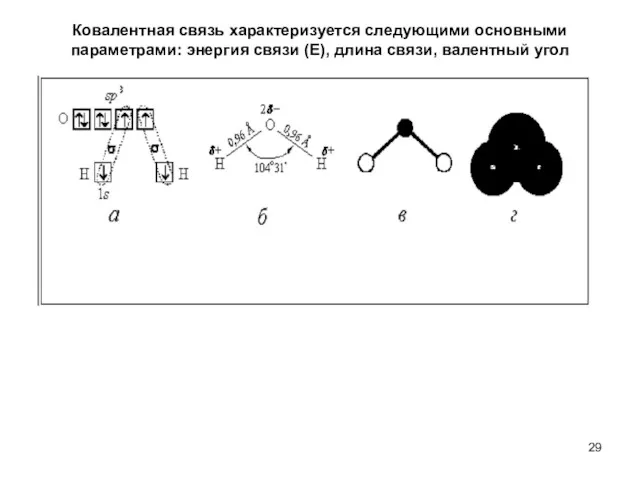
- 29. Ковалентная связь характеризуется следующими основными параметрами: энергия связи (Е), длина связи, валентный угол
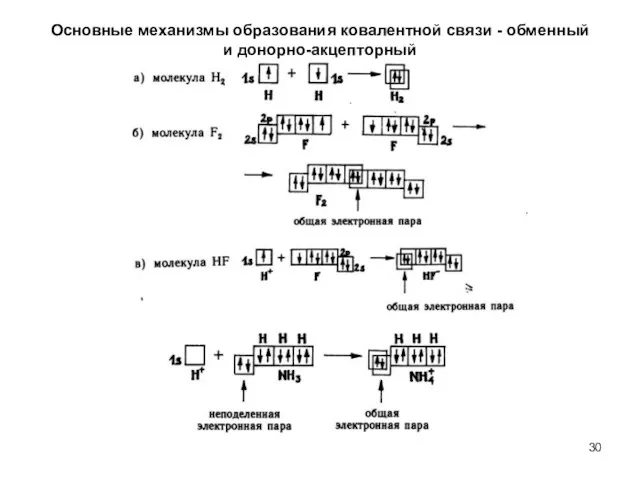
- 30. Основные механизмы образования ковалентной связи - обменный и донорно-акцепторный
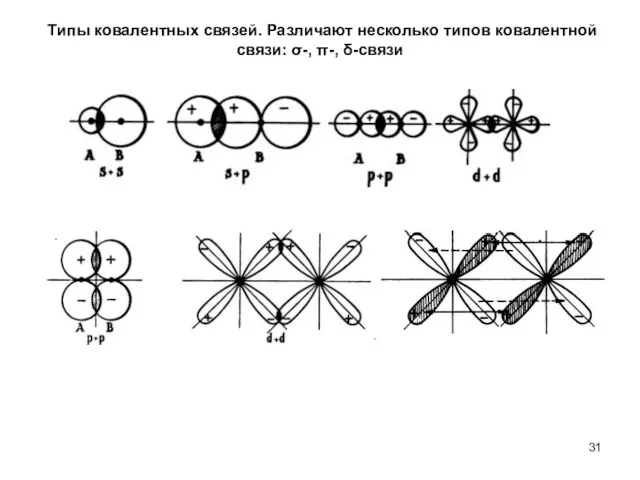
- 31. Типы ковалентных связей. Различают несколько типов ковалентной связи: σ-, π-, δ-связи
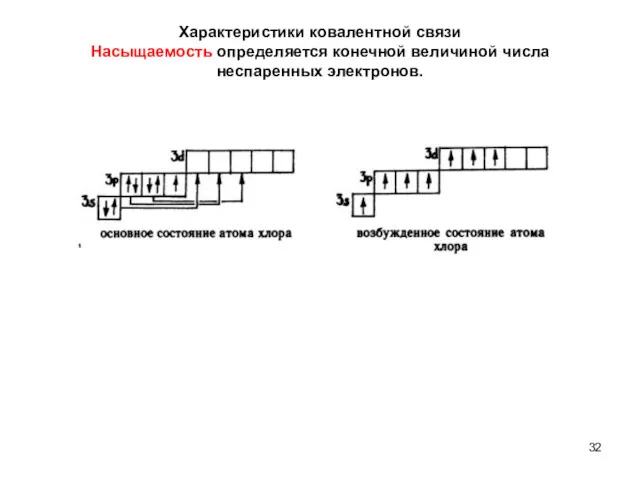
- 32. Характеристики ковалентной связи Насыщаемость определяется конечной величиной числа неспаренных электронов.
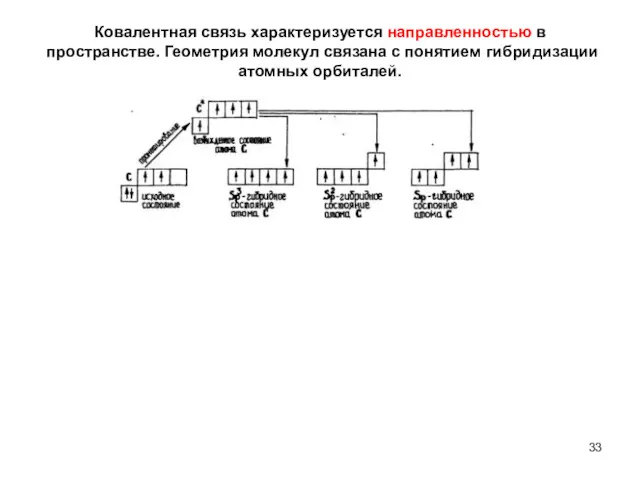
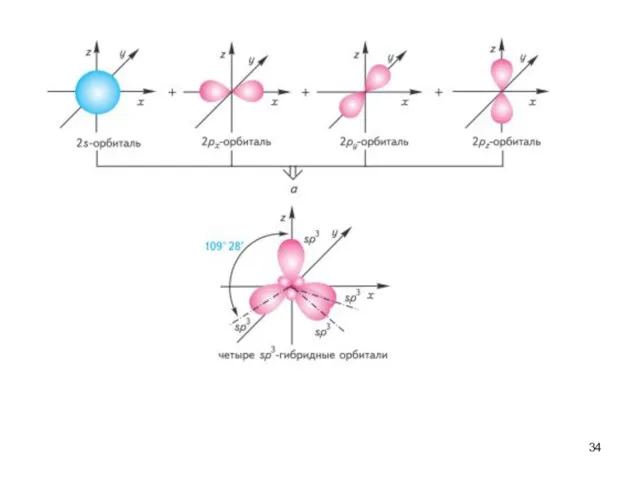
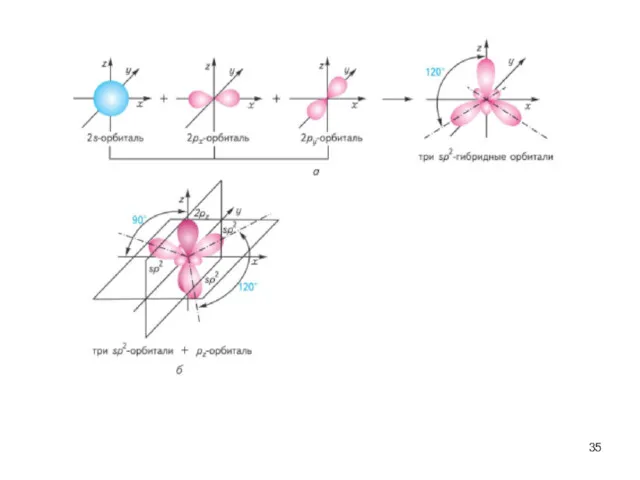
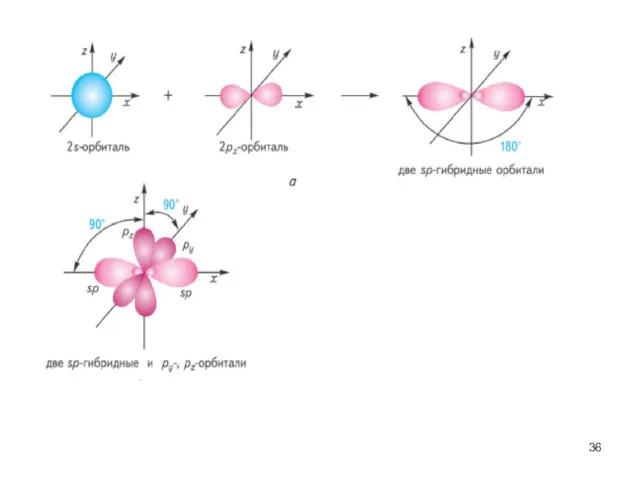
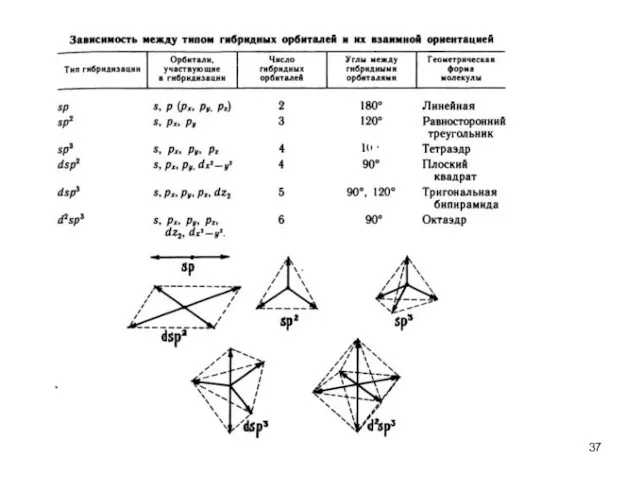
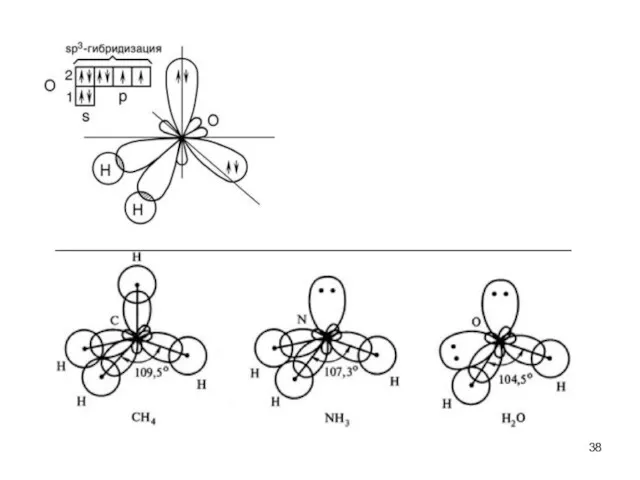
- 33. Ковалентная связь характеризуется направленностью в пространстве. Геометрия молекул связана с понятием гибридизации атомных орбиталей.
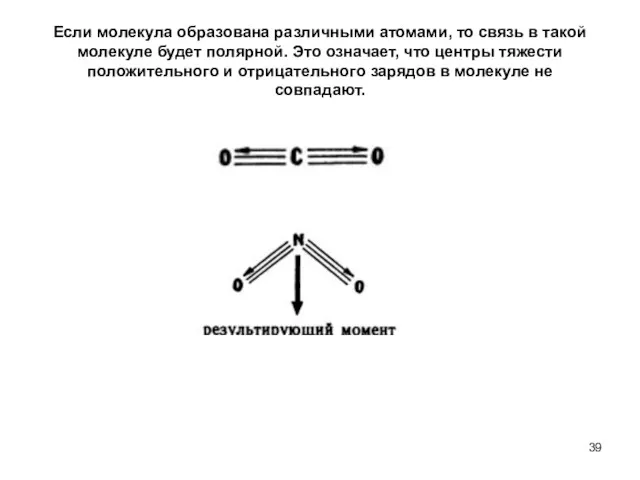
- 39. Если молекула образована различными атомами, то связь в такой молекуле будет полярной. Это означает, что центры
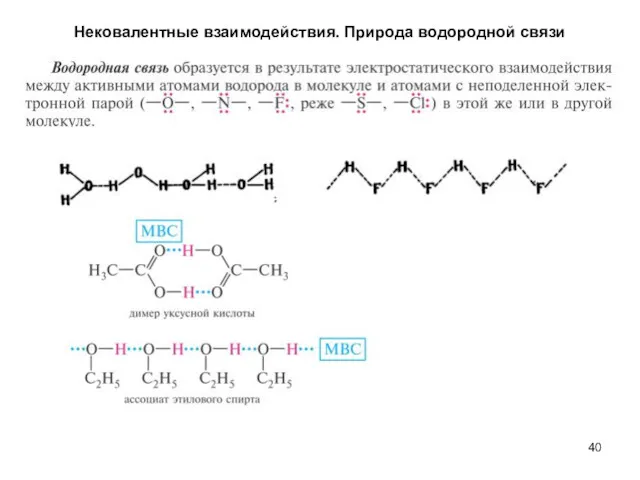
- 40. Нековалентные взаимодействия. Природа водородной связи
- 41. Металлическая связь
- 43. Скачать презентацию



















 Protein and amino acid metabolism
Protein and amino acid metabolism Спирты. Лекция
Спирты. Лекция Свойства НЦ
Свойства НЦ Марганец. Железо
Марганец. Железо Фосфор и его соединения
Фосфор и его соединения Основні класи неорганічних сполук
Основні класи неорганічних сполук Спектроскопия лазерных кристаллов
Спектроскопия лазерных кристаллов Соли: карбонаты, галоиды, сульфаты
Соли: карбонаты, галоиды, сульфаты Основы электрохимии
Основы электрохимии Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Окислительно-восстановительные реакции. Лабораторная работа
Окислительно-восстановительные реакции. Лабораторная работа Получение высокодисперсных проводящих оксидов - носителей платинового катализатора для низкотемпературных топливных элементов
Получение высокодисперсных проводящих оксидов - носителей платинового катализатора для низкотемпературных топливных элементов Смог и его виды
Смог и его виды Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Каменный уголь. Фенол
Каменный уголь. Фенол Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Алкадиены
Алкадиены Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Электрохимические накопители энергии
Электрохимические накопители энергии Непредельные углеводороды
Непредельные углеводороды Mercury. Mercury cycle
Mercury. Mercury cycle Валентність хімічних елементів
Валентність хімічних елементів Реакции ионного обмена
Реакции ионного обмена Коллоидная химия
Коллоидная химия Природный и попутный нефтяные газы
Природный и попутный нефтяные газы Алкины. Гомологический ряд
Алкины. Гомологический ряд Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций