Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза
для человека не определена.
При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга.
Сообщений о случаях отравления марганцем у людей, вызванных приемом пищи с высоким содержанием марганца, нет. В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве. Оно проявляется в виде тяжелых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона.
Токсичность марганца











 Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов
Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов Ионные уравнения реакций
Ионные уравнения реакций Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары
Алкандар,жалпы формуласы, гомологтық қатары, изомерлері, атаулары Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Водород. Свойства водорода
Водород. Свойства водорода Периодическая система химических элементов Д.И.Менделеева
Периодическая система химических элементов Д.И.Менделеева Химический состав клетки
Химический состав клетки Лекция 4. Физико-химические свойства растворов
Лекция 4. Физико-химические свойства растворов Відносна молекулярна маса
Відносна молекулярна маса Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Электролиз. 11 класс
Электролиз. 11 класс ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Химические элементы в космосе. Космогеохимия
Химические элементы в космосе. Космогеохимия Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Вирощування кристалів в додомашніх умовах
Вирощування кристалів в додомашніх умовах Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Алкины. Тема 4
Алкины. Тема 4 Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Сhemistry in English and chemical elements in English
Сhemistry in English and chemical elements in English Металлические стёкла
Металлические стёкла Галогены. Элементы VII группы
Галогены. Элементы VII группы Антибиотики пенициллинового ряда
Антибиотики пенициллинового ряда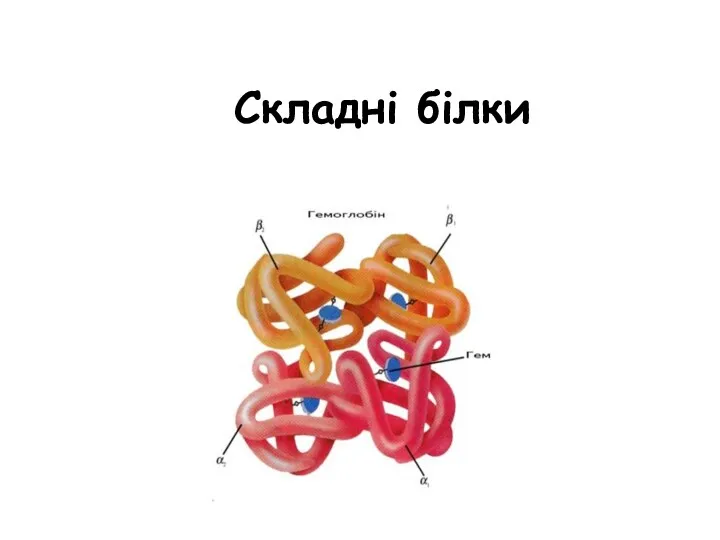 Складні білки
Складні білки