Содержание
- 2. Соединения алюминия В природе алюминий встречается только в виде соединений и по распространенности в земной коре
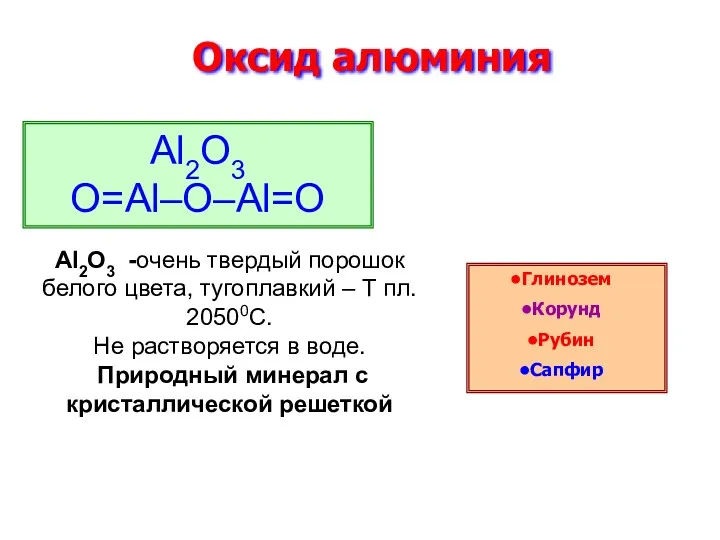
- 3. Оксид алюминия Al2O3 O=Al–O–Al=O Глинозем Корунд Рубин Сапфир Al2O3 -очень твердый порошок белого цвета, тугоплавкий –
- 4. Получение оксида алюминия Образуется: а) при окислении или горении алюминия на воздухе 4Al + 3O2 =
- 5. Получение оксида алюминия Алюминий окисляется на воздухе: 4Al + 3O2 = 2Al2O3 восстановитель Al0 - 3ē
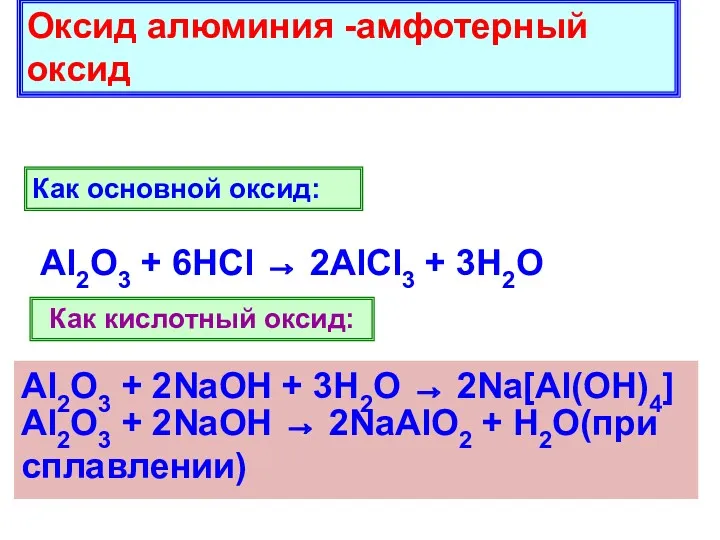
- 6. Оксид алюминия -амфотерный оксид Как основной оксид: Al2O3 + 6HCl → 2AlCl3 + 3H2O Как кислотный
- 7. Химические свойства оксида алюминия Al2O3 по характеру амфотерный оксид. Взаимодействует: а) с кислотами: Al2O3 + 3H2SO4
- 8. Гидроксид алюминия Al(OH)3 AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl Гидроксид алюминия Al(OН)3 – белое, кристаллическое
- 9. Амфотерный гидроксид взаимодействует: с кислотами и со щелочами Как основание: Al(OH)3 + 3HCl → AlCl3 +
- 10. Гидроксид алюминия Белый нерастворимый в воде порошок Проявляет амфотерные свойства. Взаимодействует: а) с кислотами: Al(OH)3 +
- 11. Соли алюминия Растворимы в воде Нерастворимые в воде: фосфаты Разлагаются водой: сульфиты, сульфиды Соли неустойчивых алюминиевых
- 12. Применение сапфиров и рубинов
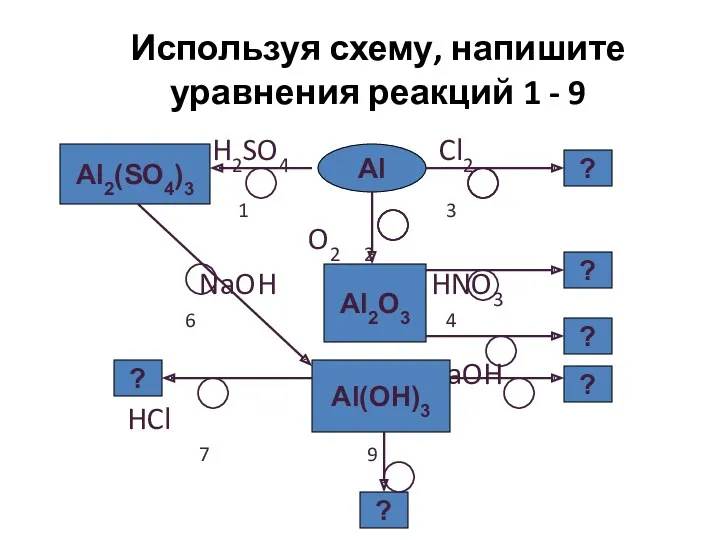
- 13. Используя схему, напишите уравнения реакций 1 - 9 H2SO4 Cl2 1 3 O2 2 NaOH HNO3
- 15. Скачать презентацию








 Значення хімічних процесів у природі
Значення хімічних процесів у природі Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Химические реакции
Химические реакции Присадки. Механизм действия присадок
Присадки. Механизм действия присадок Лекция 6. Растворы электролитов
Лекция 6. Растворы электролитов Материаловедение. Кристаллизация. Диаграмма фазового состояния железо – углерод. Превращения в сталях
Материаловедение. Кристаллизация. Диаграмма фазового состояния железо – углерод. Превращения в сталях Виды химической связи
Виды химической связи Трансмиссионные масла
Трансмиссионные масла Простые вещества металлы
Простые вещества металлы Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле Арены. Бензол и его гомологи
Арены. Бензол и его гомологи Плотность нефти и нефтепродуктов
Плотность нефти и нефтепродуктов Катализ и катализаторы
Катализ и катализаторы 20230205_okislitelno-_vosstanovitelnye_reaktsii
20230205_okislitelno-_vosstanovitelnye_reaktsii Чистые вещества, смеси
Чистые вещества, смеси Тақырып. Ароматик көмірсутектер
Тақырып. Ароматик көмірсутектер Химическая связь
Химическая связь Электролитическая диссоциация
Электролитическая диссоциация Alcohols. Learning Objectives
Alcohols. Learning Objectives Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Нефть и ее роль в мировой экономике
Нефть и ее роль в мировой экономике Нуклеопротеины
Нуклеопротеины Кислоты. Классификация кислот, их химические свойства
Кислоты. Классификация кислот, их химические свойства Фазовые диаграммы и статистическая термодинамика бинарных m-h систем
Фазовые диаграммы и статистическая термодинамика бинарных m-h систем Алюминий и его сплавы
Алюминий и его сплавы Искусственная и синтетическая резина
Искусственная и синтетическая резина Чистые вещества и смеси
Чистые вещества и смеси Экспресс-методы решения задач по химии
Экспресс-методы решения задач по химии