Содержание
- 2. План 6.1 Теория электролитической диссоциации С. Аррениуса 6.2 Теории слабых и сильных электролитов 6.3 Электропроводность растворов
- 3. 6.1 Электролиты – это вещества, способные в растворах и расплавах диссоциировать на ионы. К ним относятся
- 4. Самопроизвольный распад электролитов на ионы, протекающий под воздействием растворителя, называется электролитической диссоциацией, теория которой была создана
- 5. Сванте Аррениус (1859-1927) Шведский физико-химик, основные работы которого посвящены учению о растворах электролитов и кинетике химических
- 6. Основные положения теории С. Аррениуса 1. В растворах электролитов происходит самопроизвольный распад (диссоциация) молекул на ионы,
- 7. Степень диссоциации электролита (α) определяет электропроводность раствора: число молекул, распавшихся на ионы α = ------------------------------------------- общее
- 8. 2. Осмотическое давление, температура кипения и плавления, а также другие свойства растворов, зависят не только от
- 9. где n - число ионов, на которые распадается молекула электролита: NaCl n = 2 Na2SO4 n
- 10. i – изотонический коэффициент (коэффициент Вант-Гоффа); в бесконечно разбавленных растворах если α →1, то i →
- 11. 3. Электролиты, в зависимости от степени их диссоциации, делятся на сильные и слабые.
- 12. Однако это деление условно, т.к. одно и тоже вещество, в зависимости от природы растворителя, может быть
- 13. NaCl в воде – сильный электролит, NaCl в бензоле – слабый электролит В дальнейшим будут рассмотрены
- 14. Современные воззрения на процесс электролитической диссоциации объединяют идеи Аррениуса и учение Д.И. Менделеева о растворе, как
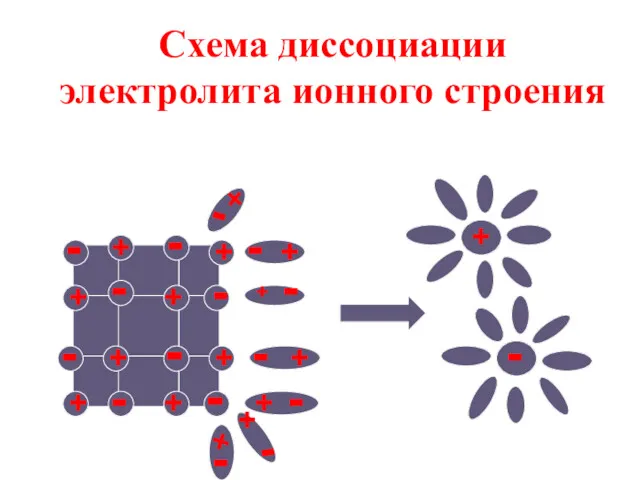
- 15. Схема диссоциации электролита ионного строения + + + + + + + + - - -
- 16. Экспериментальным путем определяются числа гидратации, показывающие, сколько молекул воды связано с одним ионом: H+ Li+ Na+
- 17. Роль растворителя в процессе диссоциации описывается законом Кулона: q1× q2 ε × r2 F =
- 18. где F – сила электростатического притяжения ионов, q1 и q2 – заряды ионов, r – расстояние
- 19. ε – диэлектрическая постоянная растворителя, показывающая во сколько раз взаимодействие между ионами в данной среде меньше,
- 20. ε(H2O)~81; ε(C2H5OH) ~ 24, для большинства орг. растворителей ε = 2-2,5.
- 21. В воде сила взаимодействия между ионами понижается в 80 раз, и собственные колебания частиц в узлах
- 22. Вода является лучшей средой для диссоциации электролитов.
- 23. 6.2.1 Теория слабых электролитов К слабым электролитам относятся ковалентные соединения, обратимо (частично) диссоциирующие в водных растворах.
- 24. К ним относятся: а) почти все органические и многие неорганические кислоты: H2S, H2SO3, HNO2, HCN, и
- 25. В растворах слабых электролитов устанавливается равновесие между молекулами веществ и их ионами: KaтAн⇄Kaт++Aн- α
- 26. Данные равновесия описываются с помощью констант равновесия, называемых константами диссоциации (Кдис).
- 27. К дис = [Кaт]×[Aн] ____________ [KaтAн]
- 28. Частными случаями Кдис являются: константы кислотности Ка, константы основности Кb, константы нестойкости Кн, (характеризует диссоциацию комплексных
- 29. Слабые электролиты подчиняются закону разбавления Оствальда, получившего Нобелевскую премию в 1909 за работы в области химического
- 30. При разбавление раствора водой степень электролитической диссоциации электролита увеличивается : α2 1 – α Кдис =
- 31. Если α α ≈ √ Кдис/См
- 32. 6.2.2 Теория сильных электролитов Дебая-Гюккеля (1923) Сильными электролитами называются соединения с ионным или ковалентным полярным типом
- 33. К сильным электролитам относятся: Некоторые неорганические кислоты: HCl, HClO4, HNO3, H2SO4 и др., Щелочи: NaOH, KOH,
- 34. KaтAн → Kaт++ Aн- α = 1
- 35. Из-за высокой концентрации ионов в растворе сильного электролита создается собственное электромагнитное поле, интенсивность которого определяется величиной
- 36. Пример. Рассчитайте ионную силу 0,1 М раствора азотной кислоты HNO3 → H+ + NO3- = 0,1M
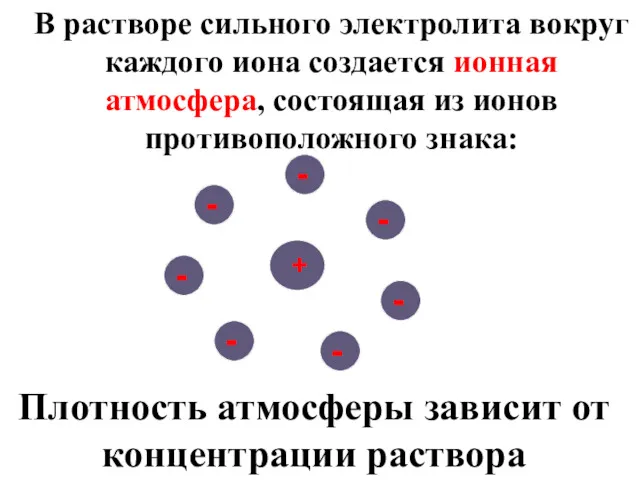
- 37. В растворе сильного электролита вокруг каждого иона создается ионная атмосфера, состоящая из ионов противоположного знака: +
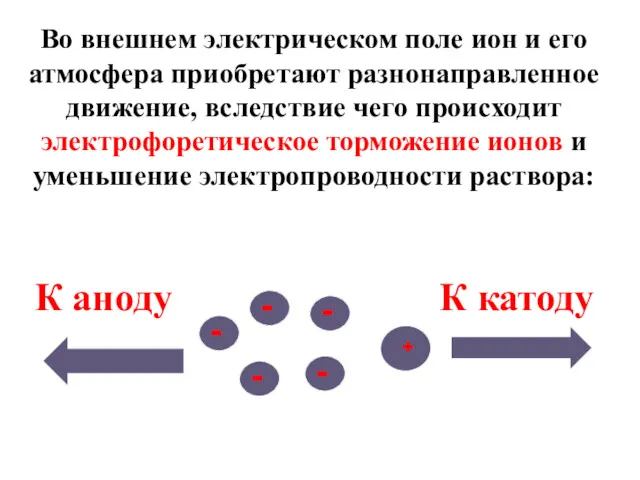
- 38. Во внешнем электрическом поле ион и его атмосфера приобретают разнонаправленное движение, вследствие чего происходит электрофоретическое торможение
- 39. Из-за уменьшения электропроводности, вызванной взаимным торможением ионов, создается впечатление, что концентрация ионов в растворе меньше, чем
- 40. а = γ См где γ – коэффициент активности иона, характеризующий отклонение физических свойств растворов от
- 41. В растворах сильных электролитов ионы проявляют свои свойства не в соответствии с их концентрацией, а в
- 42. 6.3 Растворы электролитов являются проводниками второго рода; тип проводимости ионный. Если в раствор электролита опустить электроды
- 43. Электропроводность растворов при постоянной температуре зависит от количества ионов и их подвижности(U), т.е. скорости перемещения к
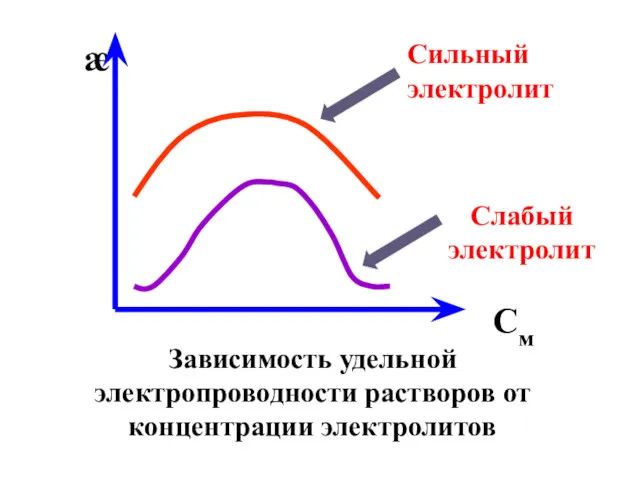
- 44. Зависимость удельной электропроводности растворов от концентрации электролитов См Сильный электролит Слабый электролит
- 45. В области разбавленных растворов рост концентрации приводит к увеличению электропроводности, что связано с увеличением числа ионов;
- 46. Для слабых электролитов данная зависимость обусловлена уменьшением степени диссоциации (закон Оствальда); для сильных – усилением электрофоретического
- 47. Органы и ткани организма электропроводны, т.к. содержат растворенные электролиты. Изменение проводимости тканей и клеток свидетельствует о
- 48. Удельная электропроводность биологических тканей организма (370С)
- 49. При заболеваниях почек удельная электропроводность мочи может уменьшаться до 0,9 -1,4 Ом-1м-1, что связано с уменьшением
- 50. При диабете электропроводность мочи также уменьшается из-за повышенного содержания сахара, являющегося неэлектролитом.
- 51. Электрическая проводимость тканей лежит в основе таких физиотерапевтических методов лечения как ионофорез, электростимуляция, ультравысокочастотная терапия.
- 52. Для физико-химических исследований широко применяется молярная электропроводность растворов (λ): λ = æ ____________________ См
- 53. λ = α (U+ + U-) При бесконечно большом разбавлении раствора α →1 и λ∞ =
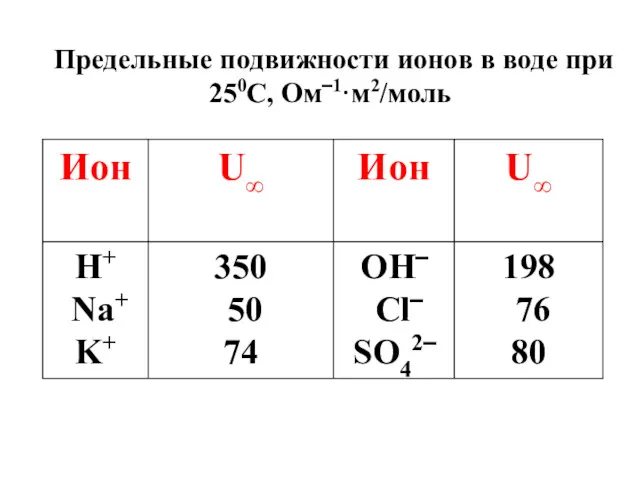
- 54. Предельные подвижности ионов в воде при 250С, Ом‾1·м2/моль
- 55. По данным электропроводности можно определить степень диссоциации электролитов (α) и растворимость труднорастворимых электролитов (S): λ æ
- 56. 6.4 Электролиты играют важную роль в жизнедеятельности организма. Общее содержание катионов в плазме крови ~154 ммоль/л.
- 57. Общее содержание анионов в плазме ~154 ммоль/л. К важнейшим анионам относятся Cl-, HCO3-, SO42-, H2PO4-, HPO42-,
- 58. Ионная сила плазмы крови составляет ~0,15 моль/л. Каждый ион выполняет свои особые функции и, кроме того,
- 59. а) удерживают воду в виде гидратов; б) создают осмотическое давление биологических жидкостей. Существование перепадов осмотического давления
- 60. в) влияют на растворимость газов, а также белков, аминокислот и других органических соединений.
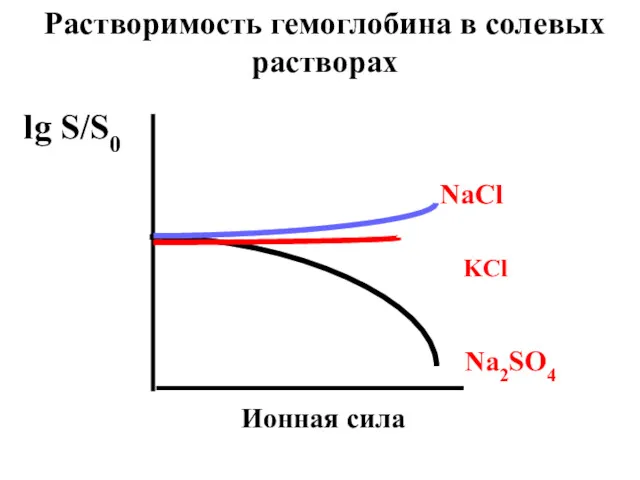
- 61. В разбавленных растворах наблюдается солевой эффект – увеличение растворимости веществ в присутствии электролитов;
- 62. В концентрированных растворах имеет место эффект высаливания – уменьшение растворимости веществ в присутствии электролитов.
- 63. NaCl KCl Na2SO4 Ионная сила lg S/S0 Растворимость гемоглобина в солевых растворах
- 65. Скачать презентацию
























![К дис = [Кaт]×[Aн] ____________ [KaтAн]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/120282/slide-26.jpg)



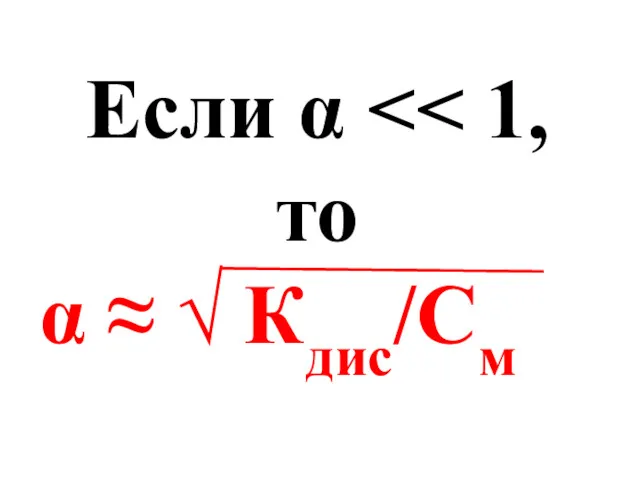


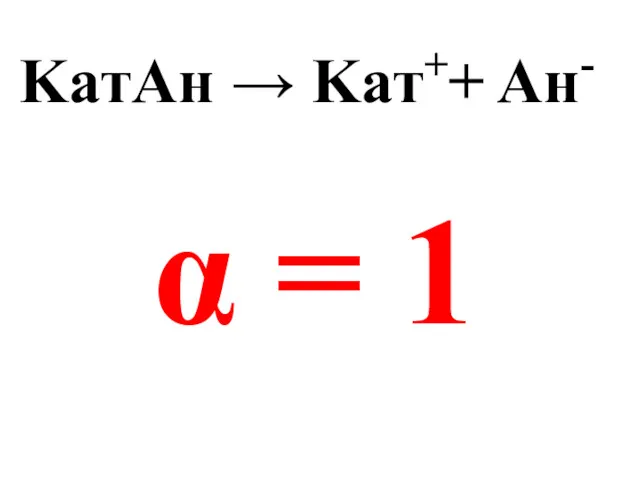
























 Спектрофометрия
Спектрофометрия Характеристика s,p,d,f - элементов
Характеристика s,p,d,f - элементов Химическое кафе Кислоты
Химическое кафе Кислоты Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Фосфор и его соединения. Электронные формулы атома фосфора
Фосфор и его соединения. Электронные формулы атома фосфора Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Химия углеводов
Химия углеводов Пластмаси та їх роль у сучасному виробництві
Пластмаси та їх роль у сучасному виробництві Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Интересные факты о химических веществах
Интересные факты о химических веществах Observing change. Chemical reactions
Observing change. Chemical reactions Группа веществ, изолируемых полярными растворителями
Группа веществ, изолируемых полярными растворителями Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Полимеры. Полимерные материалы
Полимеры. Полимерные материалы Crystal defects
Crystal defects Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Диеновые углеводороды или алкадиены (тема 4)
Диеновые углеводороды или алкадиены (тема 4) Milk Composition. Proteins - Молоко
Milk Composition. Proteins - Молоко Капиллярная конденсация
Капиллярная конденсация Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Періодична система хімічних елементів. Хімія. 8 клас
Періодична система хімічних елементів. Хімія. 8 клас Щелочные металлы
Щелочные металлы Альдегиды и кетоны
Альдегиды и кетоны Изучение упругости диссоциации карбоната кальция
Изучение упругости диссоциации карбоната кальция Дикарбоновые , гидроксикислоты
Дикарбоновые , гидроксикислоты Organic molecules
Organic molecules Обмен липидов
Обмен липидов