Содержание
- 2. В металл – водородных (M-H) системах, реализованы все виды химических связей: ионная, ковалентная и металлическая. Но
- 3. 4.1 Введение к фазовым диаграммам Некоторые примеры фазовых диаграмм показаны на рис.. 4.1 - 4. На
- 4. Перед началом обсуждения этих особенностей есть смысл сделать следующий, комментарий по значению и использованию диаграмм x-T.
- 5. Поэтому, при построении фазовой диаграммы системы Pd−D (рис. 4.1), например, мы должны делать ряд изотермических измерений
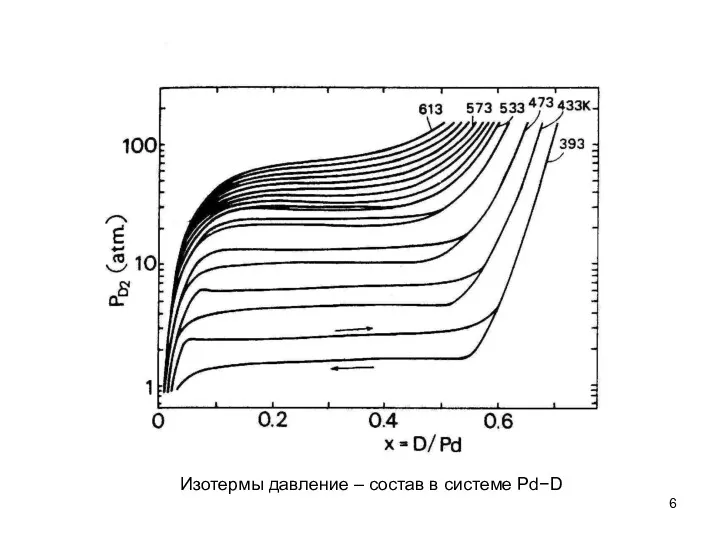
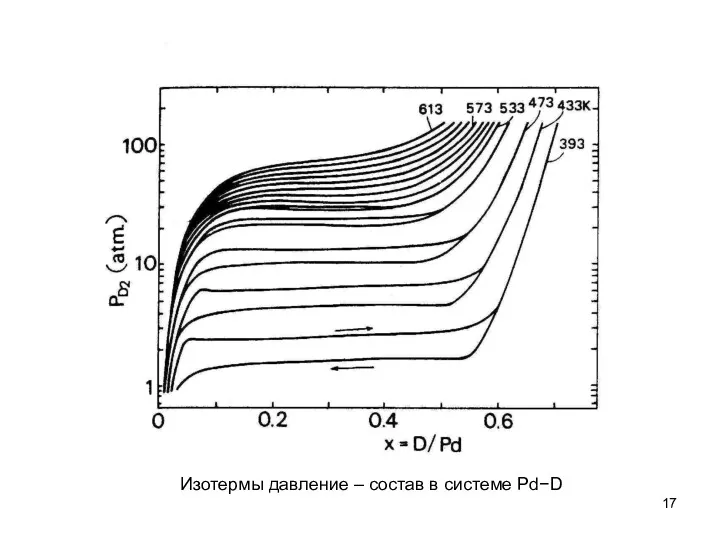
- 6. Изотермы давление – состав в системе Pd−D
- 7. Появление плато на изотерме подразумевает, что два гидрида (дейтерида) сосуществует в этой области. Правило фаз Гиббса
- 8. В большинстве других переходных металлах поверхностные состояния, блокирующие проникновение водорода легко формируются при экспозиции и ограничивают
- 9. Обычная практика для формирования порошковых образцов должна повторять циклы нагревание - охлаждение при 400÷500 °C достаточное
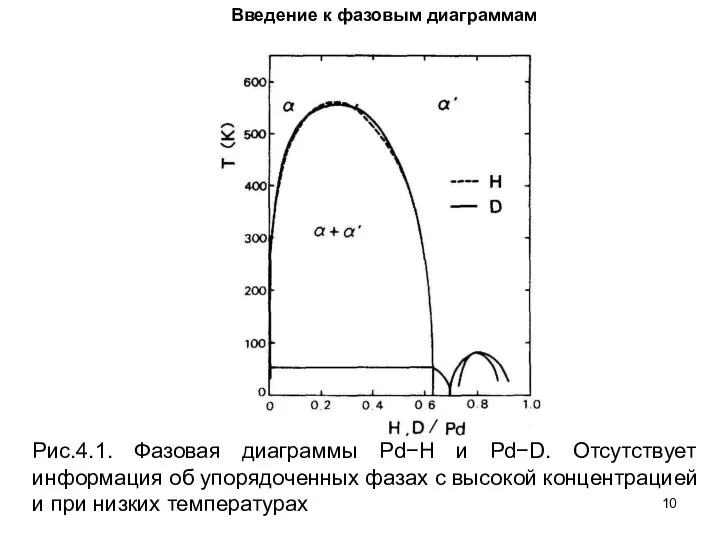
- 10. Введение к фазовым диаграммам Рис.4.1. Фазовая диаграммы Pd−H и Pd−D. Отсутствует информация об упорядоченных фазах с
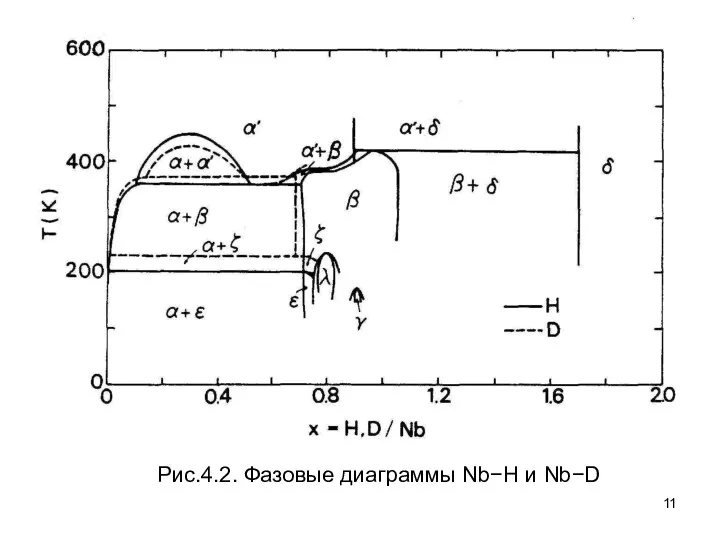
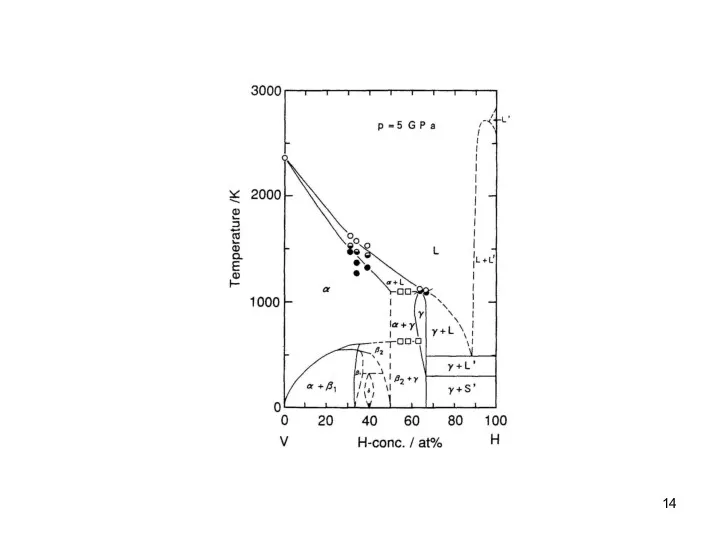
- 11. Рис.4.2. Фазовые диаграммы Nb−H и Nb−D
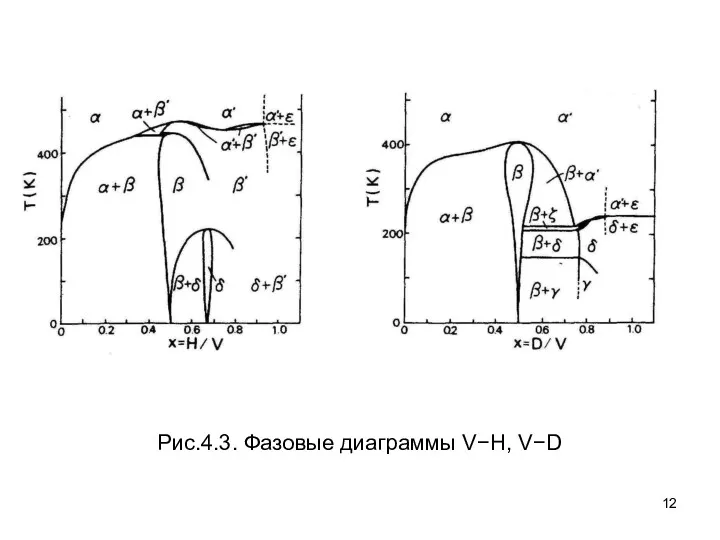
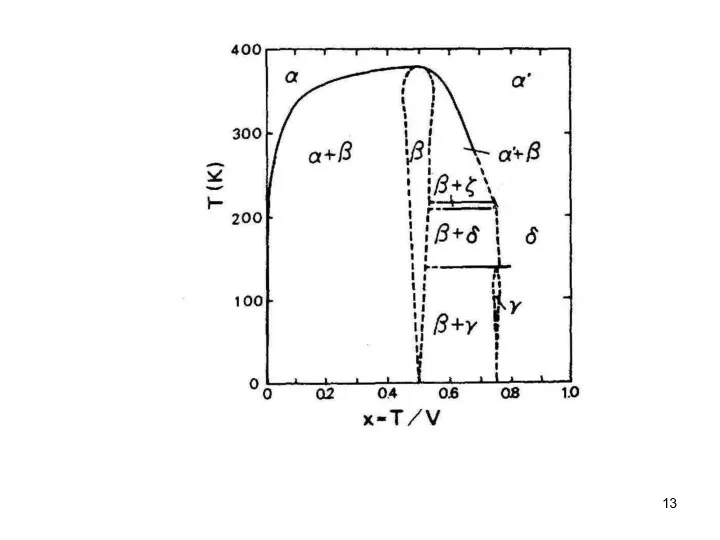
- 12. Рис.4.3. Фазовые диаграммы V−H, V−D
- 15. Таким образом, при построении фазовой диаграммы системы Pd - D (рис. 4.1), например, мы должны делать
- 16. Правило фаз Гиббса показывает, что в двухкомпонентных системах, существующих в трех различных фазах одновременно (две гидридных
- 17. Изотермы давление – состав в системе Pd−D
- 18. В большинстве других переходных металлах, поверхностные состояния, блокирующие проникновение водорода легко формируются при экспозиции, и ограничивают
- 19. Так как объемная диффузия водорода идет довольно быстро, кинетика твердо - газового насыщения обычно определяется проникновением
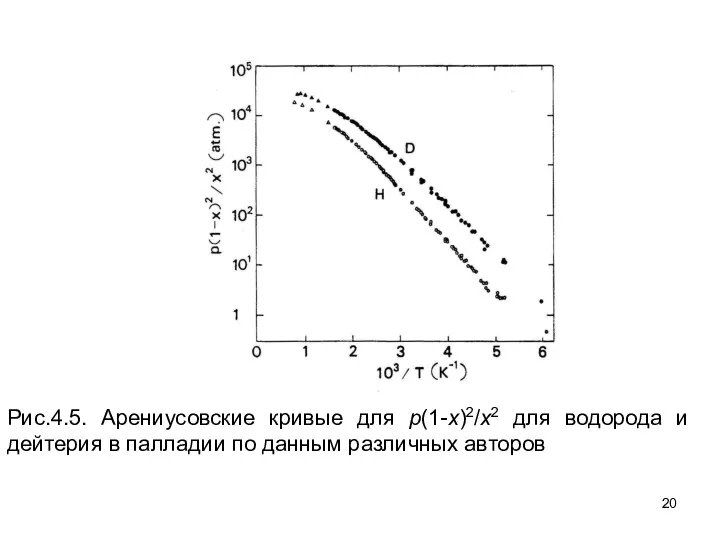
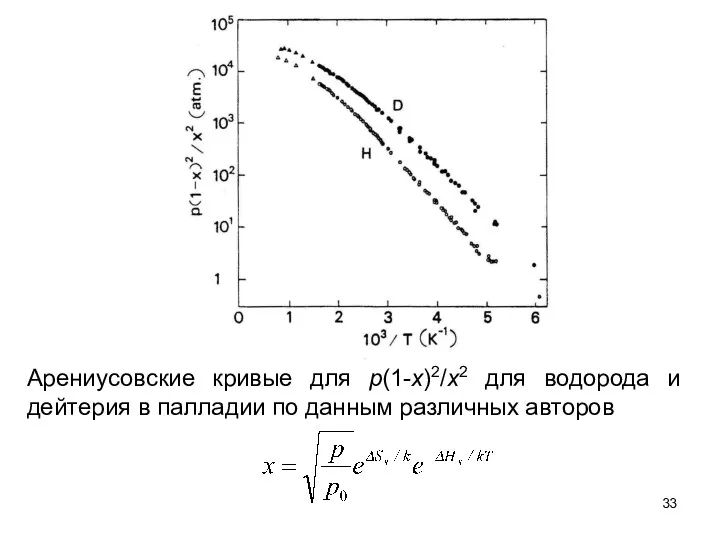
- 20. Рис.4.5. Арениусовские кривые для p(1-x)2/x2 для водорода и дейтерия в палладии по данным различных авторов
- 21. 4.2. Образование твердых растворов 4.2.1. Низкие концентрации – идеальные твердые растворы При данной температуре растворимость водорода
- 22. Рассмотрим условие теплового равновесия между твердым раствором и H2 газом, Условие дается равенством химического потенциала водорода
- 23. где μg - химический потенциал газообразного водорода на молекулу, μa является таковым для водорода в твердом
- 32. Закон Сивертса соблюдается, прежде всего, потому, что Н2 молекулы разделяются на атомы при растворении в металлах,
- 33. Арениусовские кривые для p(1-x)2/x2 для водорода и дейтерия в палладии по данным различных авторов
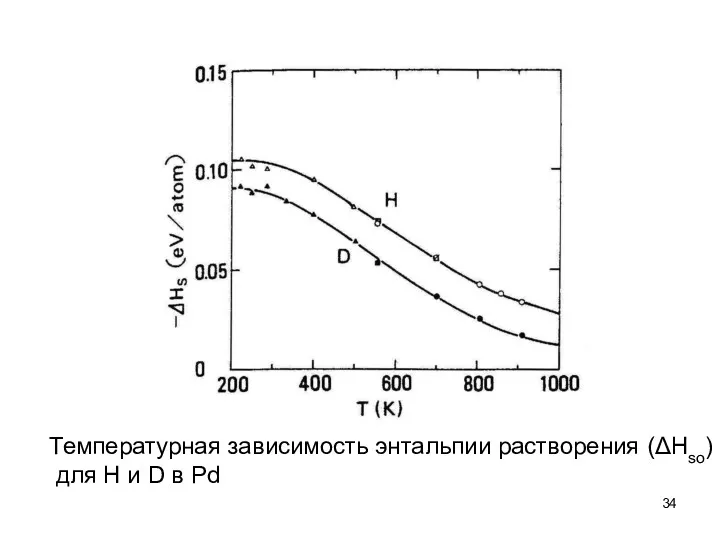
- 34. Температурная зависимость энтальпии растворения (ΔHso) для H и D в Pd
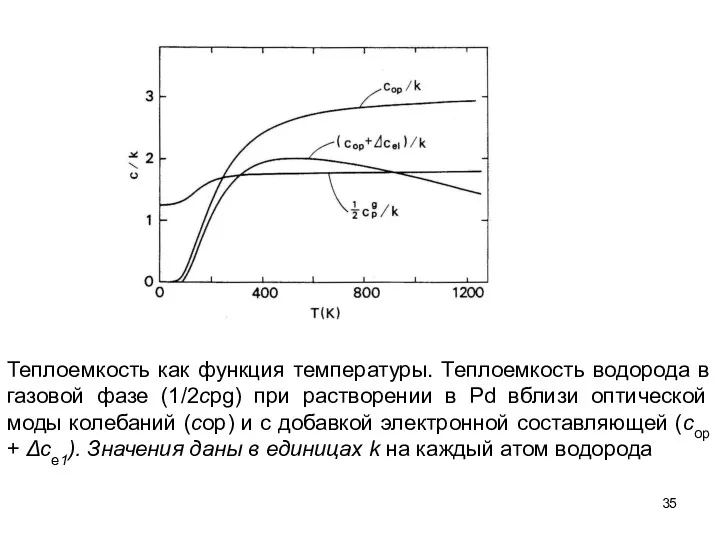
- 35. Теплоемкость как функция температуры. Теплоемкость водорода в газовой фазе (1/2сpg) при растворении в Pd вблизи оптической
- 36. В заключение этого раздела можно сделать некоторый общий комментарий к закону Сивертса. Закон Сивертса соблюдается прежде
- 37. Высокие концентрации. Взаимодействие между атомами водорода Концентрационная зависимость ΔHs должна быть следствием взаимодействий между растворенными H
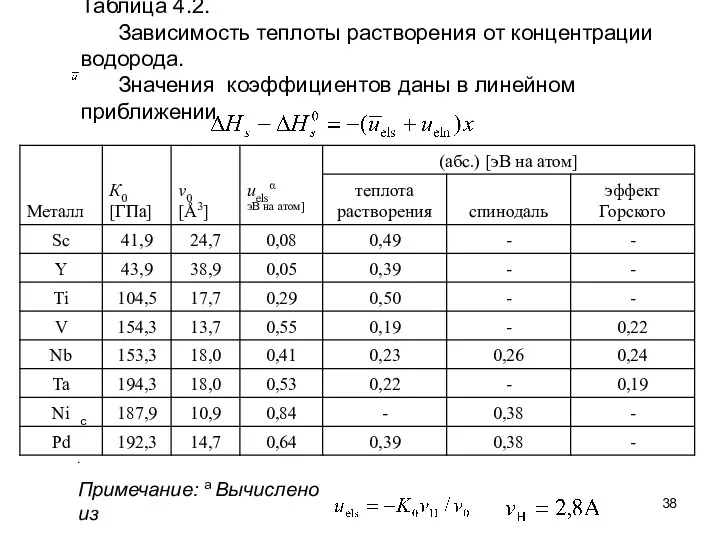
- 38. Таблица 4.2. Зависимость теплоты растворения от концентрации водорода. Значения коэффициентов даны в линейном приближении Примечание: a
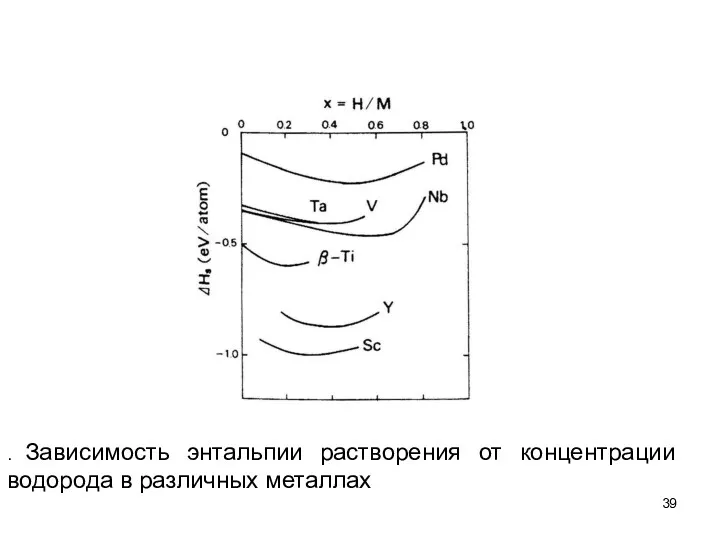
- 39. . Зависимость энтальпии растворения от концентрации водорода в различных металлах
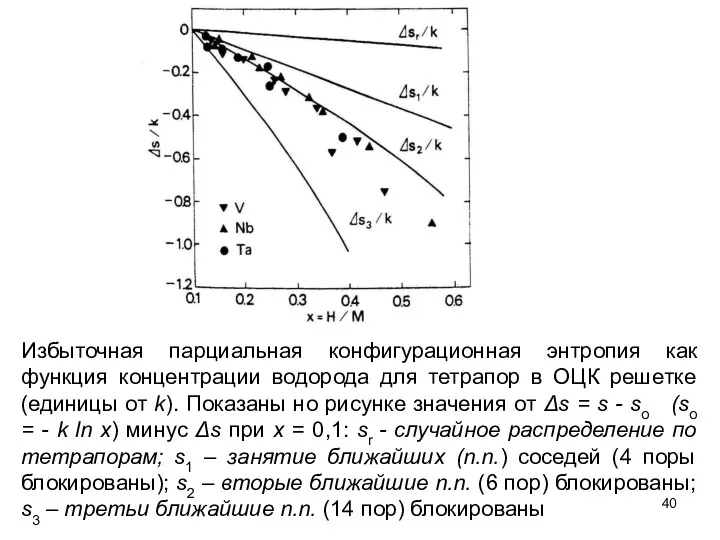
- 40. Избыточная парциальная конфигурационная энтропия как функция концентрации водорода для тетрапор в ОЦК решетке (единицы от k).
- 41. Отметим три обстоятельства, которые указывают на присутствие этого близкодействующего отталкивающего взаимодействия. Во-первых, имеется эмпирическое правило, согласно
- 42. Конфигурационная энтропия меньше, потому что r уменьшается при взаимной блокировке атомов H. Более точно, взаимная блокировка
- 43. Одно из важных последствий дальнего притягивающего H−H взаимодействия – спинодальный распад, как это наблюдается в Pd−H
- 44. Это так называемый закон общей касательной. Критическая точка может быть определена из условия Равновесное состояние для
- 45. Критическая точка может быть определена из условия (4.43) Простая аппроксимация для μa, как и прежде, имеет
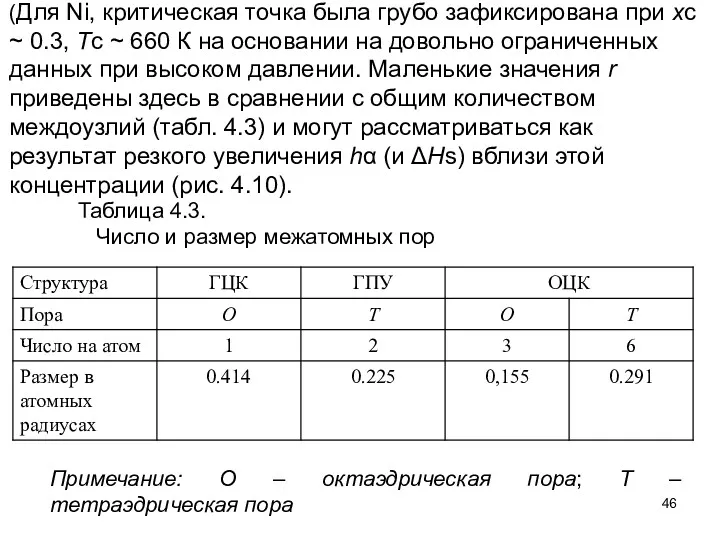
- 46. (Для Ni, критическая точка была грубо зафиксирована при xc ~ 0.3, Tc ~ 660 К на
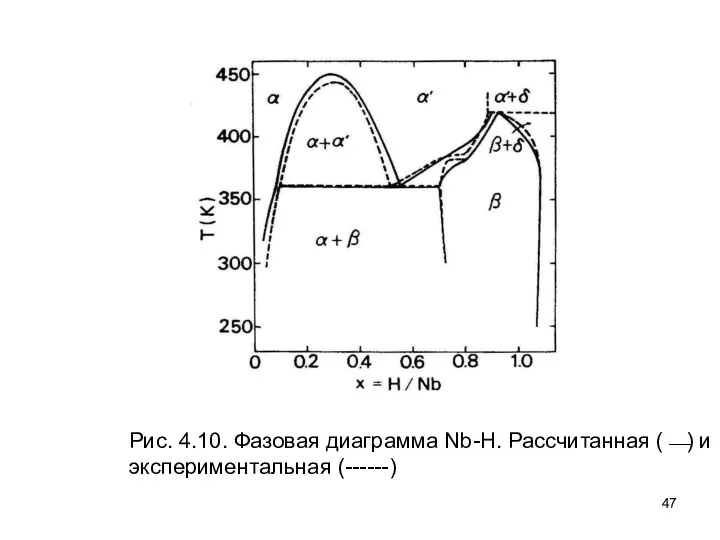
- 47. Рис. 4.10. Фазовая диаграмма Nb-H. Рассчитанная (⎯) и экспериментальная (------)
- 48. Особенность упругих дальнодействующих взаимодействий дает специфическую черту в спинодальном распаде, а именно зависимость формы границ области
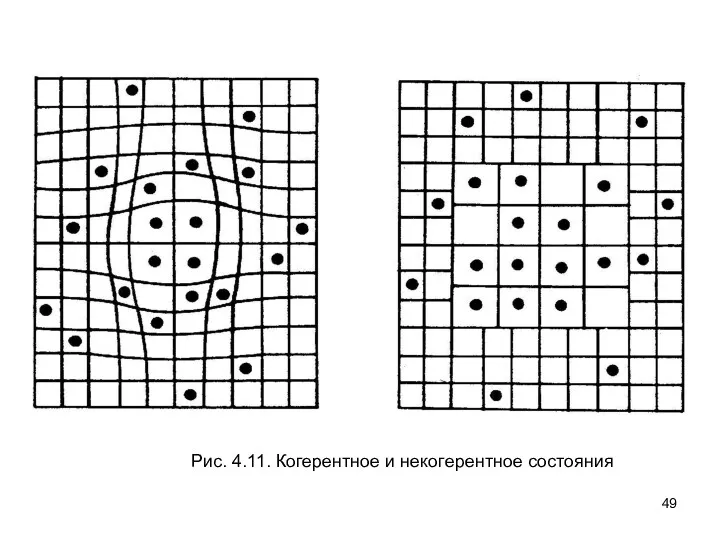
- 49. Рис. 4.11. Когерентное и некогерентное состояния
- 50. В когерентном случае, так как напряжение, введенное атомами H, зависит от концентрации H, обычные моды напряжения
- 51. Показано, что когерентные макроскопические волны плотности растут только тогда, когда отожженные образцы имеют почти предельно допустимые
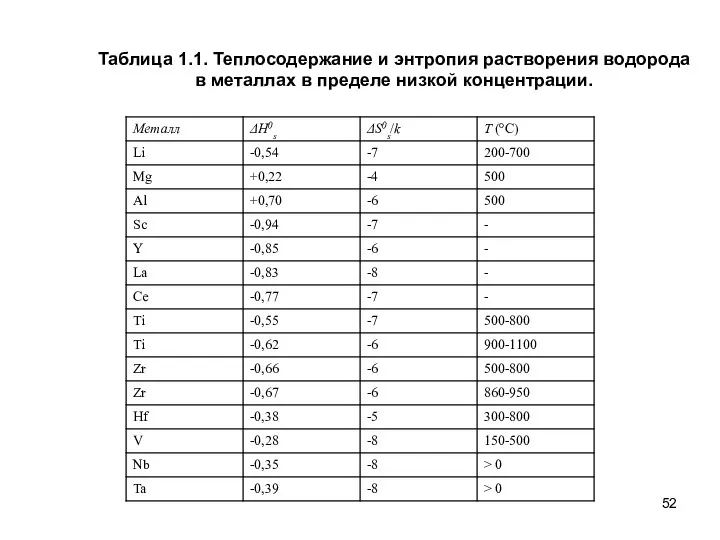
- 52. Таблица 1.1. Теплосодержание и энтропия растворения водорода в металлах в пределе низкой концентрации.
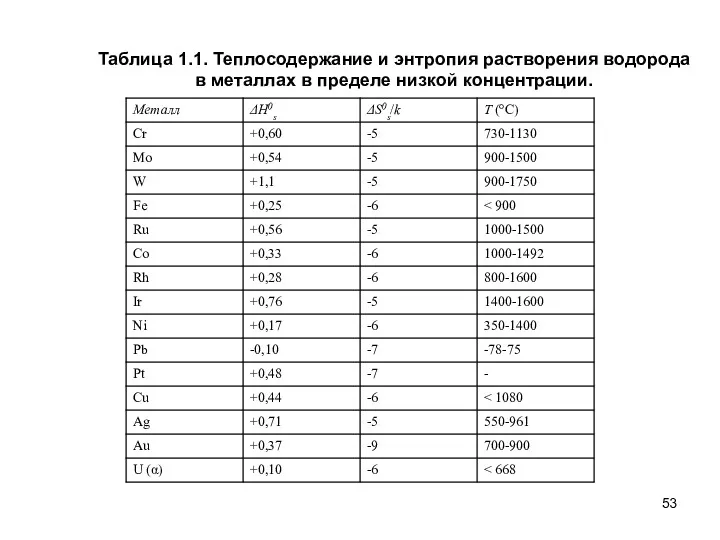
- 53. Таблица 1.1. Теплосодержание и энтропия растворения водорода в металлах в пределе низкой концентрации.
- 55. Скачать презентацию














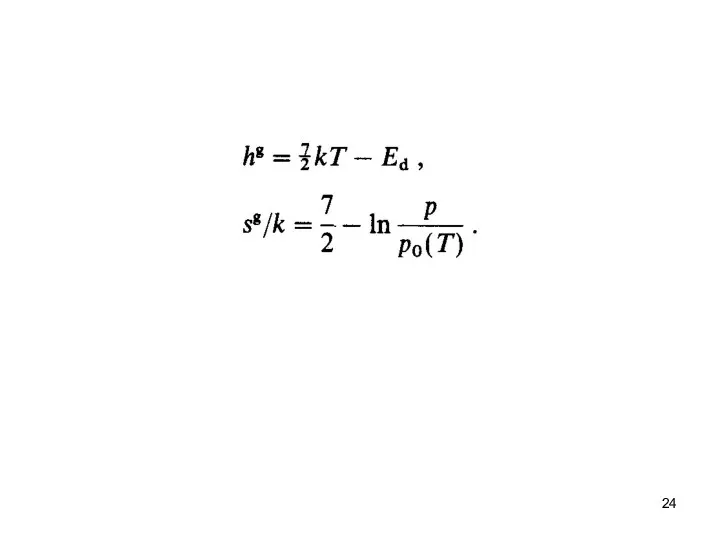


















 Пропан, C3H8
Пропан, C3H8 Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома №2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу
№2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу Якісні реакції на органічні сполуки
Якісні реакції на органічні сполуки Искусственные полимеры. 10 класс
Искусственные полимеры. 10 класс Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов Горные породы и минералы
Горные породы и минералы Химическая связь в кристаллах
Химическая связь в кристаллах Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Экстракция. Понятия в экстракции
Экстракция. Понятия в экстракции Аминокислоты. АТФ
Аминокислоты. АТФ Редкоземельные металлы
Редкоземельные металлы Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Различные теории кислот и оснований
Различные теории кислот и оснований Техника безопасности на уроках химии
Техника безопасности на уроках химии Розчин і його компоненти
Розчин і його компоненти Спектроскопия лазерных кристаллов
Спектроскопия лазерных кристаллов Розділення неоднорідної суміші. Практична робота № 2
Розділення неоднорідної суміші. Практична робота № 2 Азотжәне Фосфорэлементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар
Азотжәне Фосфорэлементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар Применение серной кислоты
Применение серной кислоты Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Растворы. Концентрация растворов
Растворы. Концентрация растворов Амины. Анилин
Амины. Анилин Минералогия литофильных редких элементов. Бериллий
Минералогия литофильных редких элементов. Бериллий Элементы VI группы главной подгруппы
Элементы VI группы главной подгруппы Генетические ряды металлов, образующих нерастворимый гидроксид
Генетические ряды металлов, образующих нерастворимый гидроксид Степень окисления
Степень окисления