Содержание
- 2. Что читать? Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Ахметов Н. С. Общая
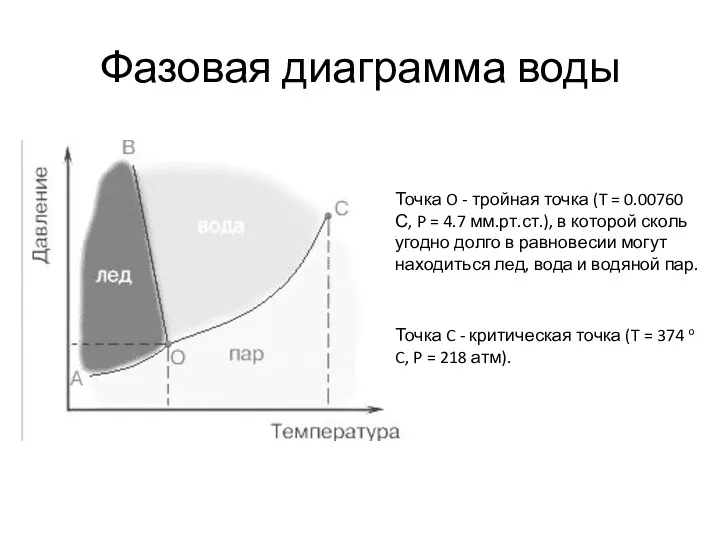
- 4. Фазовая диаграмма воды Точка O - тройная точка (T = 0.00760 С, P = 4.7 мм.рт.ст.),
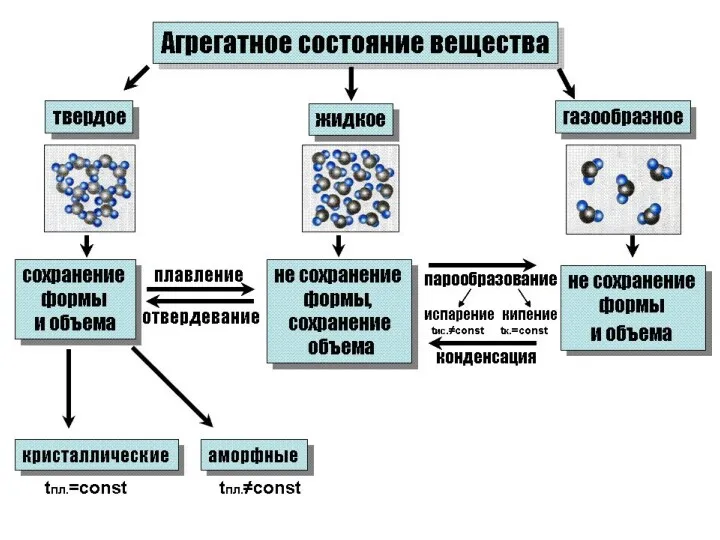
- 5. Конденсированное состояние Жидкости и твёрдые вещества имеют близкие плотности, существенно превосходящие плотности газов, поэтому их объединяют
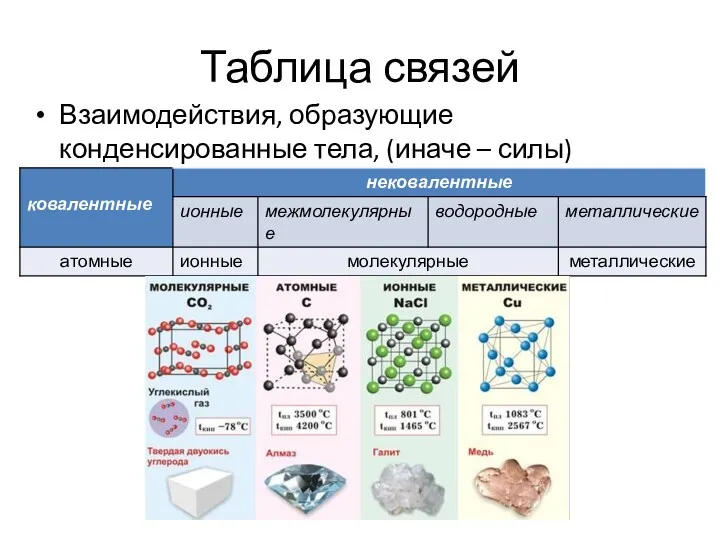
- 6. Таблица связей Взаимодействия, образующие конденсированные тела, (иначе – силы) подразделяют на пять типов:
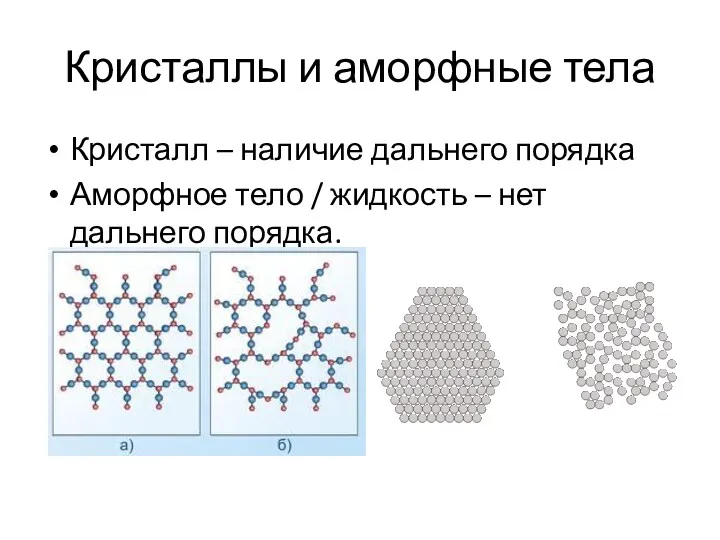
- 7. Кристаллы и аморфные тела Кристалл – наличие дальнего порядка Аморфное тело / жидкость – нет дальнего
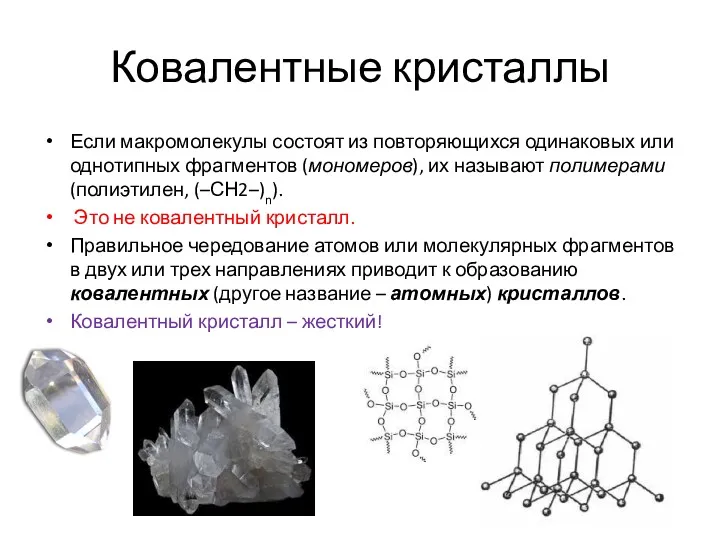
- 8. Ковалентные кристаллы Если макромолекулы состоят из повторяющихся одинаковых или однотипных фрагментов (мономеров), их называют полимерами (полиэтилен,
- 9. Кристалл = молекула Кварц – трёхмерная полимерная макромолекула (–OSiO–)n В кварце нет молекул SiО2 с двойными
- 10. Свойства ковалентных кристаллов Природа связи определяет свойства ковалентных кристаллов – физические и химические. Большая энергия ковалентной
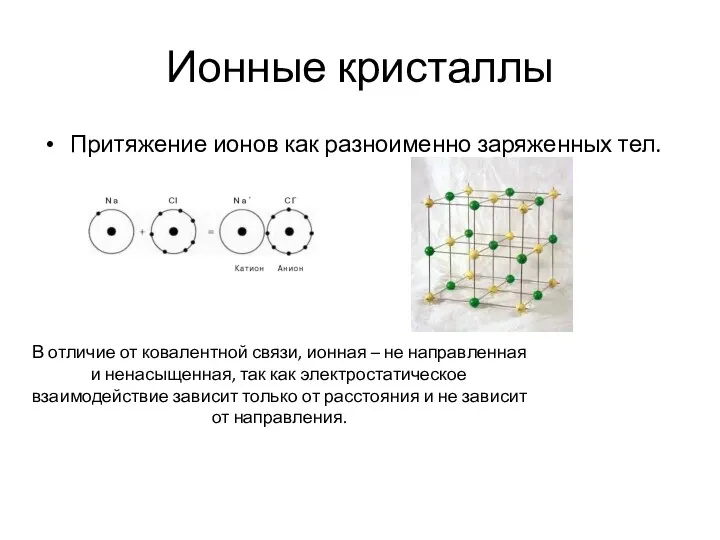
- 11. Ионные кристаллы Притяжение ионов как разноименно заряженных тел. В отличие от ковалентной связи, ионная – не
- 12. Ионные кристаллы При объединении разноименных ионов образуются ионные кристаллы. Типичные примеры – галогениды щелочных металлов, например
- 13. Поляризация Взаимодействие ионов всегда сопровождается взаимной поляризацией – смещением положительно заряженных ядер и отрицательно заряженных электронных
- 14. Свойства ионных кристаллов Характеристикой для ионных кристаллов служит хорошая растворимость в полярных растворителях (вода, кислоты и
- 15. Свойства ионных кристаллов Энергия ионной связи сопоставима с ковалентной. Кристаллы прочные – высокие температуры плавления (
- 16. Молекулярные кристаллы Существуют вещества, молекулы которых сохраняются при переходе в конденсированное состояние. Такие кристаллы называют молекулярными.
- 17. Силы, создающие молекулярные кристаллы диполь-дипольное взаимодействие (иначе – вандерваальсовое, в честь впервые рассмотревшего его голландского учёного
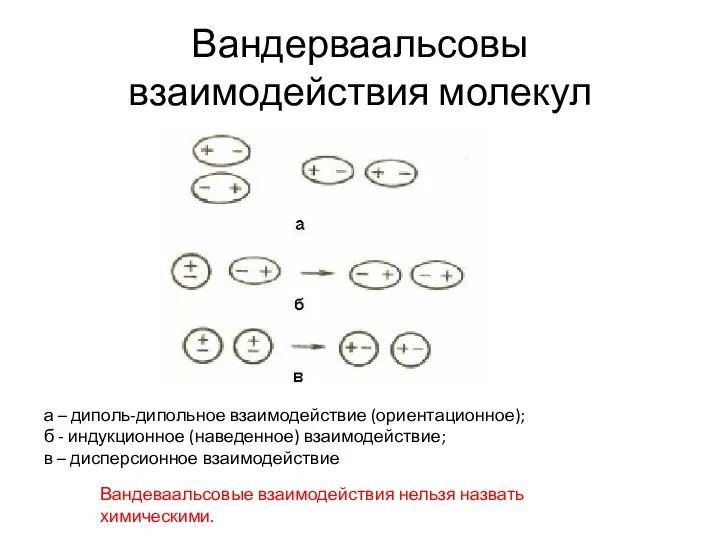
- 18. Вандерваальсовы взаимодействия молекул а – диполь-дипольное взаимодействие (ориентационное); б - индукционное (наведенное) взаимодействие; в – дисперсионное
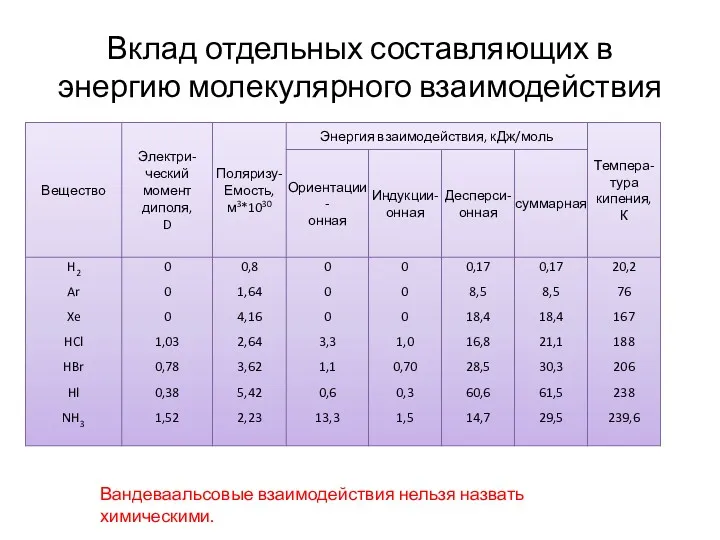
- 19. Вклад отдельных составляющих в энергию молекулярного взаимодействия Вандеваальсовые взаимодействия нельзя назвать химическими.
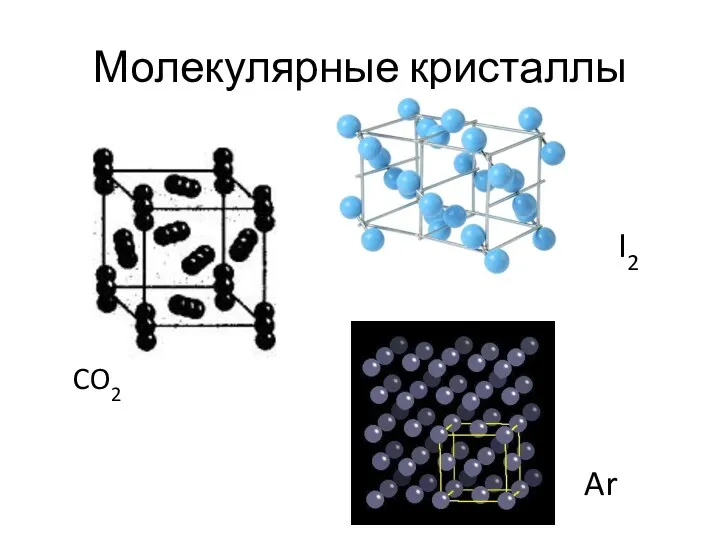
- 20. Молекулярные кристаллы CO2 I2 Ar
- 21. Молекулярные кристаллы При переходе в кристаллическое состояние характеристики ковалентных связей (длины, энергии, валентные углы) не меняются.
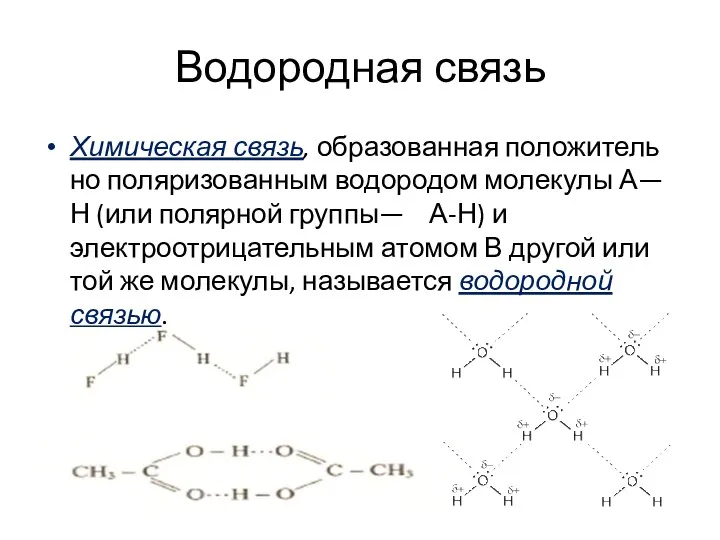
- 22. Водородная связь Химическая связь, образованная положительно поляризованным водородом молекулы А—Н (или полярной группы— А-Н) и электроотрицательным
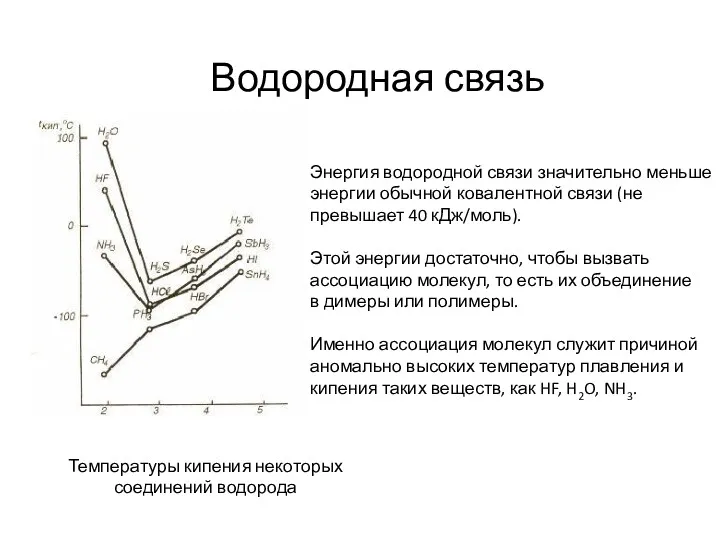
- 23. Водородная связь Температуры кипения некоторых соединений водорода Энергия водородной связи значительно меньше энергии обычной ковалентной связи
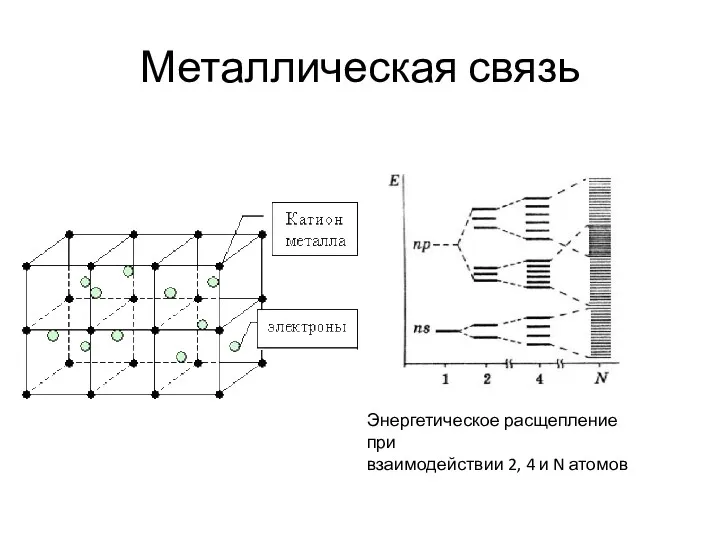
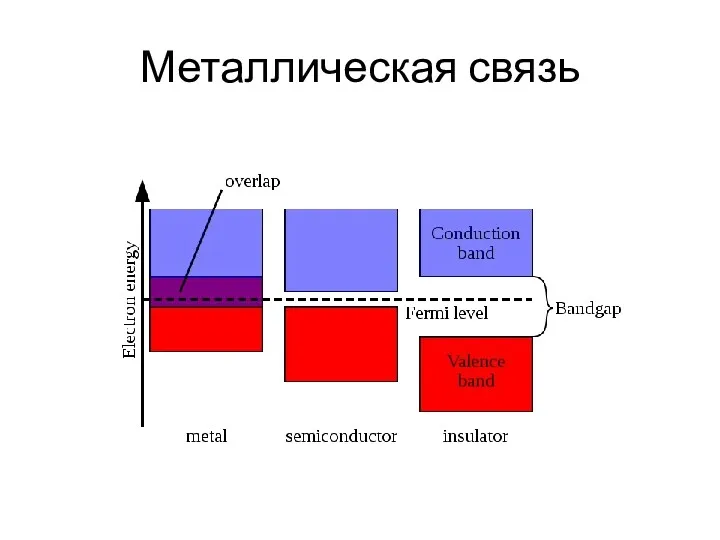
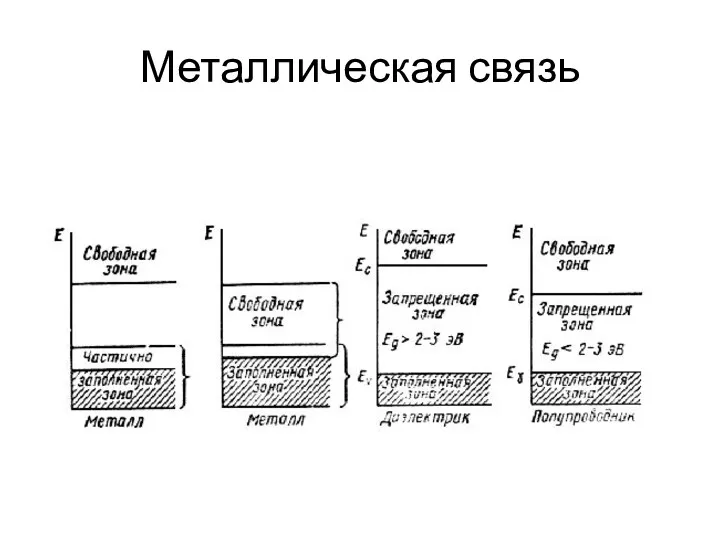
- 24. Металлическая связь Энергетическое расщепление при взаимодействии 2, 4 и N атомов
- 25. Металлическая связь
- 26. Металлическая связь
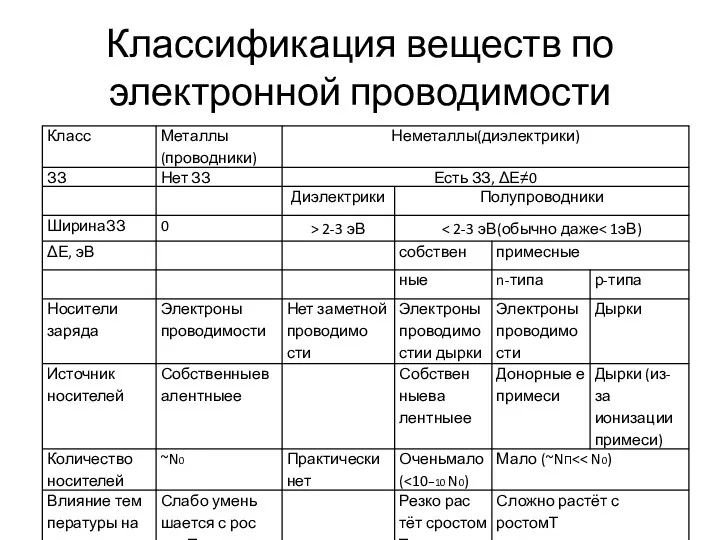
- 27. Классификация веществ по электронной проводимости
- 28. Металлы Природа металлического взаимодействия, как и всех других химических связей,– электромагнитная. Резкой границы между металлической и
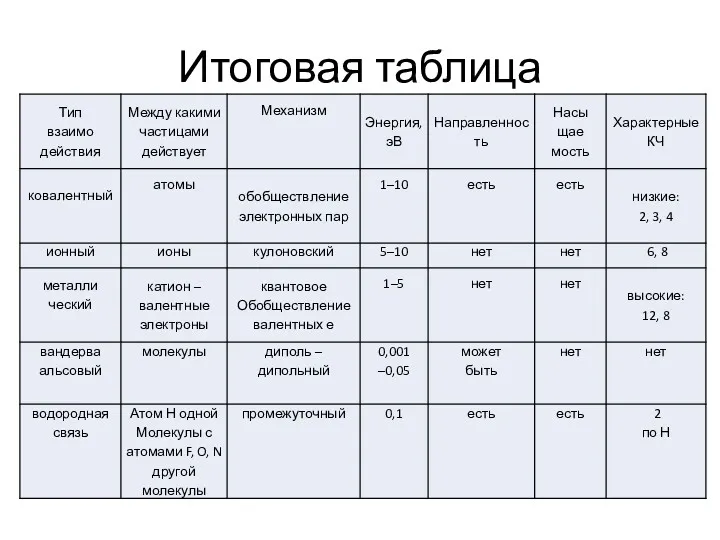
- 29. Итоговая таблица
- 31. Скачать презентацию












 Химия в повседневной жизни человека
Химия в повседневной жизни человека Химические тест-методы анализа экологических проб. Лекция 6
Химические тест-методы анализа экологических проб. Лекция 6 Значення хімічних процесів у природі
Значення хімічних процесів у природі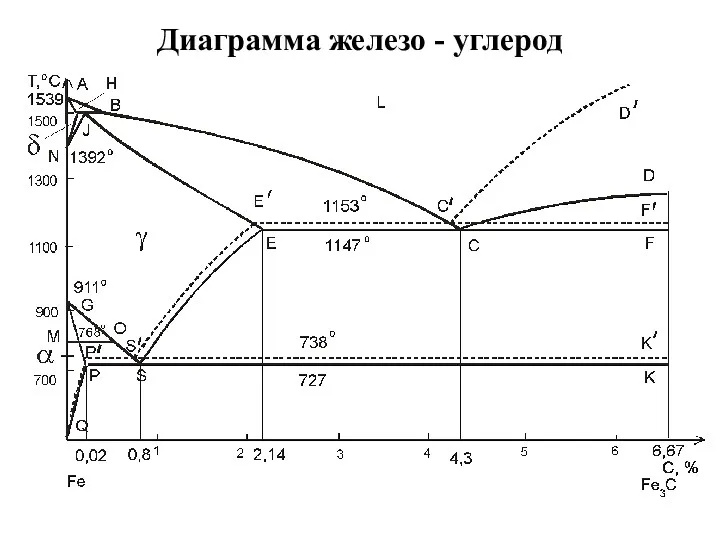 Диаграмма железо - углерод
Диаграмма железо - углерод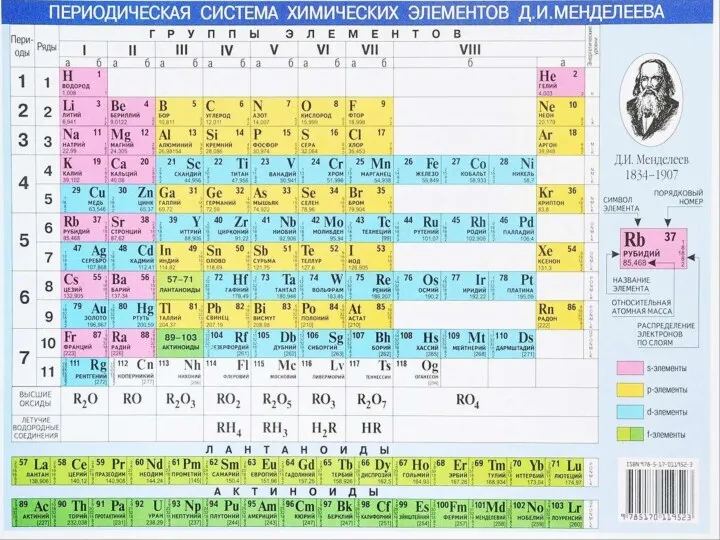 36fd4612109c46a6a8f3b83635fe0e02
36fd4612109c46a6a8f3b83635fe0e02 Основы химического равновесия
Основы химического равновесия Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Основные классы неорганических соединений
Основные классы неорганических соединений Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9)
Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9) Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Характеристика хімічного елемента Hg
Характеристика хімічного елемента Hg Теоретические основы химической технологии переработки природных энергоносителей и углеводородных материалов
Теоретические основы химической технологии переработки природных энергоносителей и углеводородных материалов Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины Centrifugal Ultrafiltration Devices
Centrifugal Ultrafiltration Devices Химический элемент и вещество
Химический элемент и вещество Номенклатура органических соединений
Номенклатура органических соединений Хром, марганец
Хром, марганец Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory Химиядан сұрақтар
Химиядан сұрақтар Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Цепные химические реакции
Цепные химические реакции Химическая термодинамика. Лекция 3
Химическая термодинамика. Лекция 3 Витаминные препараты
Витаминные препараты Водород
Водород Электролитическая диссоциация
Электролитическая диссоциация Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Введение в химию. 8 класс
Введение в химию. 8 класс